Подібно до того, як в
окремому атомі електрони можуть переходити з одного енергетичного рівня на
інший, електрони в кристалах можуть переходити з однієї дозволеної зони в іншу,
а також здійснювати переходи в середині тієї самої зони. Для переходу електрона
з нижньої енергетичної зони в сусідню, верхню, треба затратити енергію, що
дорівнює ширині забороненої зони, яка лежить між ними (енергію порядку кількох
електрон-вольт). Для переходу електрона в середині дозволеної зони потрібна
досить мала енергія. Важливо підкреслити, що наявність дозволених енергетичних
рівнів і зон ще не означає наявності електронів на цих рівнях чи в зонах.
Подібно до того як в ізольованому атомі дозволені квантова ні енергетичні рівні
можуть бути зайняті електронами чи вільні, так і в твердому тілі енергетичні
зони можуть мати різне „заповнення” електронами. Електричні властивості
твердого тіла визначаються взаємним розміщенням різних енергетичних зон і
розподілом електронів по цих зонах. Зони можуть бути повністю заповненими
електронами, повністю вільними, частково заповненими або можливе перекриття
вільних і заповнених зон. Залежно від конкретної ситуації, яка має місце,
тверде тіло має різні електричні властивості. В ізольованому атомі внутрішні
енергетичні рівні заповнені електронами повністю, частково заповненим може бути
лише крайній рівень, який називають рівнем валентних електронів. Тому
зону, яка утворилася від валентних рівнів атомів, що утворюють кристал,
називають валентною зоною. Ця
зона може бути частково або повністю заповненою електронами в залежності від
того, як заповнений електронами валентний рівень ізольованих атомів. В
ізольованому атомі вище валентного рівня знаходяться рівні енергії, на яких хоч
електронів і не має, але вони можуть там знаходитись при збудженні атомів. Для
цього валентному електронові необхідно подолати енергетичний бар’єр, що
визначається потенціалом збудження атома. Аналогічна картина спостерігається в
кристалі вище валентної зони (V-зона) розміщена повністю вільна від електронів
зона, яку називають зоною провідності
(С-зона).
З врахуванням ступені
заповнення зон можливі такі випадки зонної структури матеріалів:
1) Валентна зона заповнена не повністю (рис. 1.). Така ситуація
спостерігається тоді, коли валентний рівень атомів, з яких утворюється кристал,
заповнені частково. Наприклад, кристали елементів першої групи таблиці
Менделєєва. Візьмемо Na.
Розподіл електронів атома Na
за електронними станами :1s22s22p63s1.
Дві перші внутрішні електронні оболонки атома натрію повністю заповнені
електронами, а останній одинадцятий електрон перебуває на 3s- рівні, заповнюючи
його на половину. При утворенні металічного натрію 3s- рівні окремих атомів колективізуються і утворюють 3s-
зону кристала натрію, теж заповнену тільки на половину.
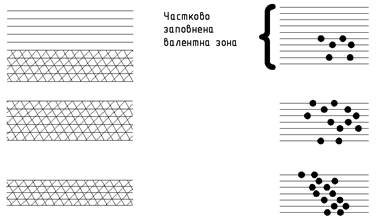
Рис.
1
Нижчим, повністю
заповненим енергетичним рівням вільного атома Na в кристалі відповідають повністю заповнені зони
1s, 2s, 2p, що об’єднують електрони однакових енергетичних рівнів атомів. Таким
чином, енергетична схема металічного натрію має одну верхню заповнену до
половини зону і кілька повністю заповнених зон, що відповідають енергетичним
рівням з нижчою енергією (рис. 2.). Оскільки зона 3s частково заповнена, то при
прикладанні до кристалу Na
електричного поля в ньому виникне струм. Це можливо тому, що електрони зони 3s
отримавши від електричного поля енергію мають змогу перейти на вищі, вільні
рівні. Якби зона 3s була повністю заповнена, то її електрони не змогли б
змінити свого енергетичного стану навіть при наявності електричного поля, а
отже, і не дали б вкладу в електропровідність кристалу, так само як і електрони
всіх нижчих зон (2p,2s,1s). Тому в такому випадку незаповнена валентна зона 3s
є одночасно і зоною провідності, хоч згідно нашого означення такою повинна бути
зона 3p.
2) Валентна зона заповнена повністю, але
заборонена зона між валентною зоною і зоною провідності відсутня (рис. 3.).
Рис.
2.
Область перекриття цих
двох зон називають гібридною зоною провідності, яка містить у собі
вільні енергетичні рівні. Навіть слабке зовнішнє електричне поле викликає
переміщення електронів по вільних рівнях цієї гібридної зони, і в твердому тілі
виникає струм. Таким чином, і цей випадок відповідає металічному кристалові.
Відмінність від випадку 1) полягає в тому, що
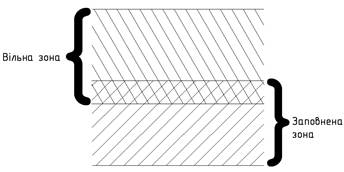
Рис.
3
в окремих атомах, із
яких утворюється цей метал, валентні рівні заповнені повністю, але найближчі до
валентних рівні знаходяться так близько, що при утворенні зон, валентна зона і
зона провідності перекриваються. Прикладом такого кристалу може бути метал,
утворений із двовалентних атомів, наприклад магній. Електронна структура
магнію 1s2 2s2 2p6 3s2. Енергія 3р-станів електронів в атомі
магнію помітно відрізняється від енергії 3s-станів, тому в кристалі магнію 3s-
та 3р-станам відповідають дві різні енергетичні зони, одна з яких повністю
заповнена, а друга – повністю вільна. Але розщеплення енергетичних рівнів у
кристалі перевищує різницю між цими рівнями в атомі, тому 3s- та 3р-зони в
кристалічному магнії частково перекривають одна одну (рис. 4).
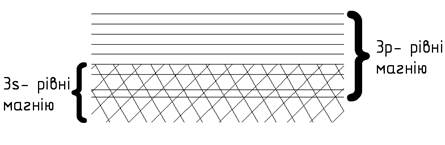
Рис.
4
Через це
електрони заповненої 3s-зони можуть вільно переходити в 3р-зону і енергетична
схема магнію має вигляд, подібний до
зонної схеми натрію.
3). Валентна зона
заповнена повністю і не перекрита із вільною зоною (зоною провідності) (рис.
5). В цьому випадку треба тільки відмітити, що якщо ширина забороненої зони при
абсолютному нулі температури більша 3еВ, то такі речовини називаються діелектриками, або ізоляторами. Речовини, що мають
при абсолютному нулі температури цілком заповнену валентну зону і ширину
забороненої зони не більше 2-3 еВ,
відносяться до напівпровідників.
Варто зауважити, що ширина заборонених зон дуже слабо залежить від температури.
Рис.
5
Прикладом діелектрика
може бути кристал кухонної солі (NaCl).
Кристал NaCl складається з
іонів Na+ та Cl-, для утворення
яких 3s- електрон атома натрію приєднуються до 3р-електронів хлору, причому
електронна структура натрію(1s2 2s2 2p6) і
хлору (1s2 2s2 2p6 3s2 3p6)
замкнена і нагадує структуру інертних газів – неону і аргону. Дозволені
енергетичні зони, що виникають у кристалі NaCl із заповнених енергетичних рівнів іонів Na+ i Cl-, будуть теж цілком
заповненими. Зони, що виникають із 3s-рівнів іона Na, та всіх інших вільних від електронів збуджених
станів іонів Na+
i Cl-
залишаються вільними. Вільна зона, утворена в кристалі NaCl з 3s-рівнів Na+, розташована на 6еВ вище від 3р-зони
хлору (рис. 6). Можливість зменшення енергії 3s-електронів натрію і є причиною
їхнього переходу у 3р-зону хлору. Отже, цілком заповнена 3р-зона хлору
відділена значним енергетичним інтервалом від вільної 3s-зони натрію, і
енергетична структура NaCl
буде: такою, як це показано на рис. 5. Типовими напівпровідниками є кристали
елементів IV групи таблиці Менделєєва германію та кремнію. В атомах цих
елементів на зовнішній електронній оболонці перебуває по 4 електрони в кремнії
3s2 3p2, а в атомах германію 4s2 4p2.
При поступовому зближенні атомів кремнію і утворенні кристалу кремнію зона, що
виникає з 3s-рівнів виявляється повністю заповненою електронами, а зона, що
виникає із 3р-рівнів, заповненою тільки частково. При дальшому зближенні атомів
3s- і 3p-зони перекриваються, утворюючи одну частково заповнену зону, а потім
знову розщеплюються на дві нові зони. Особливістю знову утворених зон є те, що
в них може розміститись по 4 електрони від кожного атома. Всіх валентних електронв є 4, тому вони
знаходяться у нижній, знову утвореній зоні, тоді як верхня зона вільна (рис.
7).
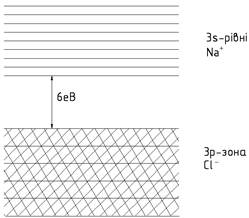
Рис.
6
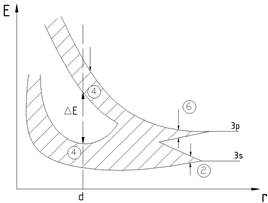
Рис.
7
Аналогічне явище
спостерігається і в кристалах германію, тільки з 4s- і 4p-станами, а в кристалах
алмазу (вуглець) з 2s- і 2p-станами. Найменшу ширину забороненої зони мають
кристали германію – 0,7еВ. В кремнії вона становить 1,1еВ, в алмазі – 5,2еВ.
Тому останній відносять до діелектриків, а перші два – напівпровідників. Аналіз
ступеня заповнення зон дозволяє в подальшому виключати із розгляду всі глибокі
зони, що лежать нижче валентної, так як електрони цих зон не впливають на
основні електро-фізичні
властивості кристалів і не беруть участі в проходженні струму через кристал.
Таким чином, зонну структуру надалі зображатимемо так, як це показано на рис.
8.
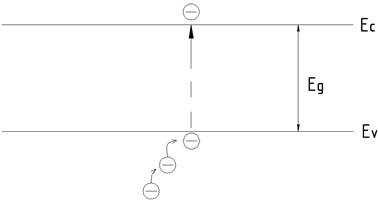
Рис.
8
Загальноприйнято для компактності зображати лише верх
валентної зони Еv,
розуміючи, що сама валентна зона розміщена нижче рівня Еv (v – valent).
Аналогічно прийнято зображати лише дно зони провідності Ес (c – conduction, провідність). Ширину забороненої зони
позначають через Еg.
В напівпровідниках та діелектриках завдяки тепловому збудженню, дії світла,
впливу досить сильного зовнішнього електричного поля та інших факторів,
електрони валентної зони можна перевести у вільну зону (зону провідності), і
тоді зовнішнє електричне поле може зумовити напрямне переміщення електронів,
тобто створюватимется
струм. З погляду зонної теорії твердого тіла, розподіл неметалевих твердих тіл
на діелектрики і напівпровідники, взагалі кажучи, є умовним через те, що він не
зумовлений ніякими фізичними особливостями. Відмінність між ними полягає тільки
в ширині забороненої зони.
Стан електропровідності у металів є нормальним,
незбудженим. Саме цим вони якісно відрізняються від напівпровідниів та діелектриків.
Таким
чином, по характеру заповнення зон електронами всі тіла можна розділити на дві
великі групи. До першої групи відносяться тіла, у яких над цілком
заповненими зонами розташована зона, заповнена лише частково (рис. 9 а). Така
зона виникає в тому випадку, коли атомний рівень, із якого вона утворюється,
заповнений не повністю, як це має місце,
наприклад, у лужних металів. Частково заповнена зона може утворитись також і
внаслідок накладання заповнених зон на незаповнені, або часково заповнені (рис. 9 б), що характерно для
лужноземельних елементів. Першу групу ще називають металами. До
другої групи відносять тіла, у яких над цілком заповненими зонами розміщені
повністю порожні зони (рис. 10). Сюди можна віднести алмаз, Ge, Si, оксиди металів, карбіди, нітриди і т.д.
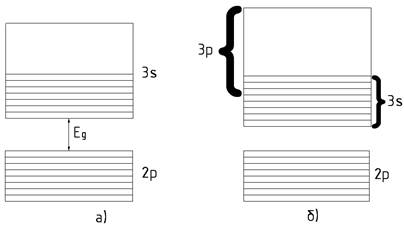
Рис.
9
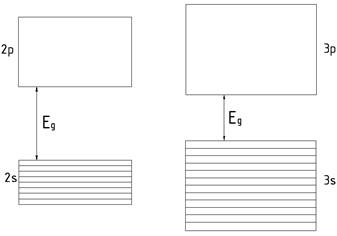
Рис.10
Ця група включає в себе
діелектрики та напівпровідники. Як уже говорилось, цей поділ є
умовним. До діелектриків відносять тіла, що мають відносно широку заборонену
зону. У типових діелектриків Еg>3eB.
Так алмаз має Еg=5,2еВ,
нітрид бору Еg=4,6еВ,
в Al2 O3 Еg=7еВ
і т.д. До напівпровідників
відносять тіла, що мають поріняно
вузьку заборонену зону. Так у германії Еg=0,66еВ,
у Si – Еg=1.08eB, в InSb – Еg=0.17eB,
в GaAs – Еg=1.43eB і т. д.