Енергетичний
спектр електронів вільних атомів суттєво змінюється, якщо з них утворюється
тверде кристалічне тіло. Прослідкувати це можна на прикладі абстрактного
експерименту по зближенню двох атомів (наприклад, Na). На великих віддалях між цими атомами їх
енергетичні спектри електронів ідентичні (рис. 1).
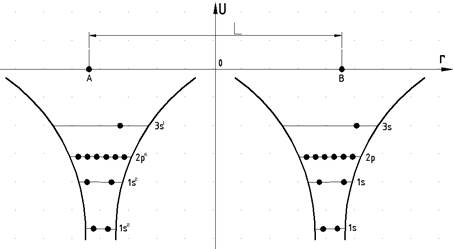
Рис.
1
Розрахунки показують,
що при L=30Å перехід електрона з рівня 3s атома А до атома В може
здійснитись в середньому 1 раз за 1020 років. Для електронів, що
перебувають на рівнях 1s, 2s, 2p ця ймовірність ще набагато менша. При
зближенні атомів електричні поля їх електронів і ядер взаємодіють щораз сильніше. Якщо раніше енергія
кожного електрона визначалась його взаємодією з ядром і електронами-сусідами,
то тепер на кожний електрон даного атома А діють ще електричні поля ядра і
електронів атома В. Ця дія призводить до зміни енергії електронів. Найближче
зближуються і найактивніше взаємодіють власні 3s електрони атомів, тому
енергетичні рівні цих електронів змінюються найбільше. Відстань між електронами
внутрішніх електронних оболонок атомів А і В більша. Крім того, дія на них
сусіднього атома екранується зовнішніми оболонками. Тому внутрішні електрони
взаємодіють слабкіше і їх енергетичні рівні
також змінюються менше. Таким чином, зближення атомів причиною того, що
відбувалось зниження і звуження потенціального бар’єру для електронів (рис. 2
б)). На рис.3а для порівняння показано енергетичний спектр ізольованого атома Na.
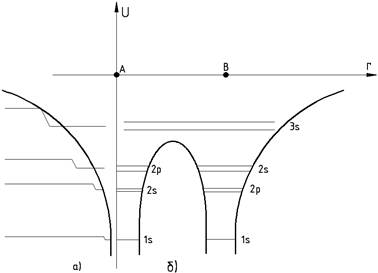
Рис.
2
Для електронів 3s
потенціальний бар’єр взагалі перестав існувати, тобто ці електрони тепер
одночасно належать обом атомам. Крім того слід ще врахувати, що розглядувана
система із двох атомів являється замкненою квантовою системою. На неї, як і на
окремий атом, поширюється дія обмежувальних квантових законів. Дійсно,
згідно принципу Паулі, на кожному енергетичному рівні у замкненій квантовій
системі можуть перебувати лише два електрони з протилежно направленими спінами. Кількість електронів в
розглядуваній системі вдвоє більша, ніж в окремому ізольованому атомі, тому
число енергетичних рівнів в системі також повинно подвоїтись порівняно з числом
рівнів окремого атома. Отже, замість поодиноких рівнів 2s, 2p,3s ізольованих
атомів виникають по два енергетичні підрівні, відстань між якими визначається
величиною взаємодії електронів. Віддаль між електронами 1s велика, взаємодія
між ними майже не проявляється, тому і їх рівні змінюються найменше (рис. 2).
Утворення
твердого кристалічного тіла можна уявити
собі як поступове зближення великого числа N атомів, що спочатку були
розташовані один відносно одного в такому самому порядку, як у кристалі, але на
таких великих відстанях, що взаємодією між ними можна було знехтувати.
Внаслідок взаємодії, замкненою квантовою системою тепер слід вважати сукупність
усіх N атомів, що утворюють кристал. Тому, згідно з принципом Паулі, замість N
енергетичних рівнів (наприклад, 3s) з однаковою енергією, на кожному з яких є
місце для двох електронів, у кристалі утворюється система з N різних
енергетичних рівнв, де
можна розмістити всі 2N однакових (ті ж 3s) електронів кристалу. На мові
законів квантової механіки це означає, що N-кратно вироджений рівень розщеплюється на N
підрівнів. І це справедливо для кожного рівня.
Отже, в
міру зближення атомів між ними виникає взаємодія, яка все зростає. Ця взаємодія
збурює початкові атомні енергетичні рівні та спричинює зміну положення рівнів.
Замість одного однакового для всіх N атомв
рівня виникає N дуже близьких, які не збігаються між собою. Таким чином, кожен
рівень ізольованого атома розщеплюється в кристалі на N густо розміщених
можливих рівнів, які утворюють смугу, або зону, енергетичну зону (рис. 3).
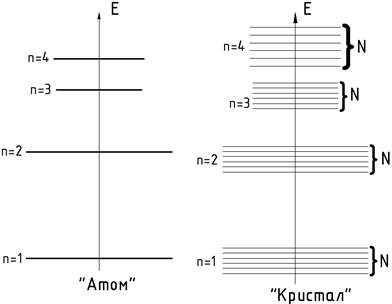
Рис.
3
Кожна зона (смуга)
являє собою розщеплений рівень атома, тому вони звичайно позначаються 1s, 2s,
2p, і т. д., тобто так само, як і рівні атома. Число електронів, енергії яких
становлять зону, може бути не більше ніж 2N в s-зонах, 6N – в p- зонах і т.д .Динаміку розщеплення рівнів
при зближенні атомів можна представити рис.5.
З рисунка
видно, що кожному рівню ізольованого атома в кристалі відповідає зона
дозволених енергій . Зони дозволених
енергій розділені областями заборонених енергій – забороненими зонами ![]() ,
, ![]() ,... Із збільшенням енергії електрона в атомі ширина
дозволених збільшується, ширина заборонених – зменшується. Це пояснюється тим,
що електрони зовнішніх оболонок взаємодіють сильніше, ніж внутрішніх. Глибокі
внутрішні рівні атомів майже зовсім не розщеплюються і залишаються такими
вузькими, як і в атомах. Відповідно до цього ширина заборонених зон зменшується
із зростанням енергії. Ширина енергетичних зон залежить від віддалі між атомами
(постійної кристалічної гратки)
і не залежить від розмірів кристалу, тобто вид матеріалу і будова кристалу
визначає ширину зон (Рис. 4).
,... Із збільшенням енергії електрона в атомі ширина
дозволених збільшується, ширина заборонених – зменшується. Це пояснюється тим,
що електрони зовнішніх оболонок взаємодіють сильніше, ніж внутрішніх. Глибокі
внутрішні рівні атомів майже зовсім не розщеплюються і залишаються такими
вузькими, як і в атомах. Відповідно до цього ширина заборонених зон зменшується
із зростанням енергії. Ширина енергетичних зон залежить від віддалі між атомами
(постійної кристалічної гратки)
і не залежить від розмірів кристалу, тобто вид матеріалу і будова кристалу
визначає ширину зон (Рис. 4).
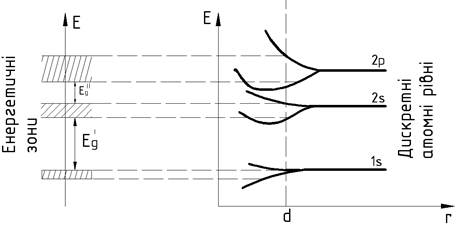
Рис.
4
Потрібно відзначити, що
енергетична зона не має ніяких просторових розмірів, вона являє собою лише
фізичне поняття, згідно якого електрони твердого тіла можуть мати обмежений
діапазон енергій. Кожен електрон може мати енергію, що не більше верхньої і
не менше нижньої межі відповідної дозволеної зони. Наявність заборонених
зон – найбільш характерна риса твердого тіла. Якщо направити пучок електронів,
енергія яких попадає в будь-яку із заборонених зон, то такі електрони не
проникають в кристал, вони повністю відбиватимуться від кристалу, під яким би
кутом їх на кристал не направляли. Ширина дозволених і заборонених зон для
більшості матеріалів лежить в межах кількох електронвольт і визначається, як уже було
підкреслено, сталою гратки.
Щільність розміщення енергетичних рівнів в кожній зоні залежить від розмірів
твердого тіла. Чим більше атомів має кристал, тим тісніше розміщуються рівні в
зоні. Якщо врахувати, що в 1см3 твердого тіла міститься близько 1022
атомів, то при ширині дозволеної зони в 1 еВ рівні в ній розміщуються один від одного на
енергетичній віддалі 10-22 еВ,(для
порівняння: середня кінетична енергія атомів ![]() при кімнатній
температурі 0,026 еВ). Це
означає, що енергетичні рівні в зоні розміщені практично неперервно. Дозволена
зона в кристалі вважається квазінеперевною.
Дискретність рівнів в зоні потрібно враховувати лише при розрахунку розподілу
електронів по енергіях, тобто по станах.
при кімнатній
температурі 0,026 еВ). Це
означає, що енергетичні рівні в зоні розміщені практично неперервно. Дозволена
зона в кристалі вважається квазінеперевною.
Дискретність рівнів в зоні потрібно враховувати лише при розрахунку розподілу
електронів по енергіях, тобто по станах.
Отже, квантовомеханічний розгляд
твердого тіла приводить до існування в спектрі енергії електронів дозволених і
заборонених зон. З ростом енергії ширина дозволених зон збільшується. Це
пояснюється тим, що перекриття електронних оболонок атомів найбільше саме для цих оболонок (рис. 5.).
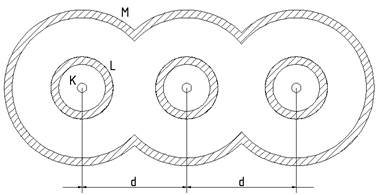
Рис.5
Іншими словами, хвильові
функції електронів зовнішніх оболонок атомів твердого тіла перекриваються най
більше.