ФІЗИЧНІ
ВЛАСТИВОСТІ МЕТАЛІВ
Всі
метали, крім ртуті (![]() ), за
звичайних умов - тверді кристалічні речовини.
У вузлах кристалічних граток металів знаходяться атоми, зовнішні
валентні електрони яких усуспільнені, вільно переміщаються у кристалі і
забезпечують хімічний зв’язок між атомами. Такий тип зв’язку називається
металічним.
), за
звичайних умов - тверді кристалічні речовини.
У вузлах кристалічних граток металів знаходяться атоми, зовнішні
валентні електрони яких усуспільнені, вільно переміщаються у кристалі і
забезпечують хімічний зв’язок між атомами. Такий тип зв’язку називається
металічним.
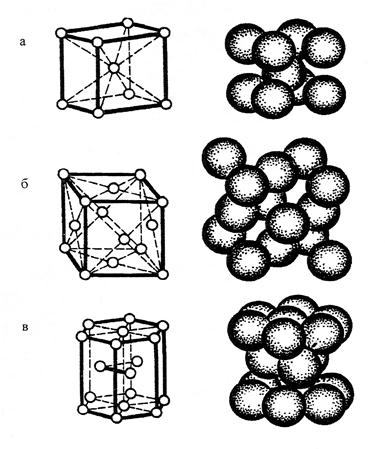 Основні типи кристалічних структур
металів показані на рисунку 1.
Основні типи кристалічних структур
металів показані на рисунку 1.
Рис.1. Кристалічні структури металів: а) структурний тип α-заліза;
б) структурний тип міді; в)
структурний тип магнію
Однаковий
тип зв’язку зумовлює ряд спільних фізичних властивостей металів, пов’язаних з
вільним переміщенням електронів:
-
високу електро- і теплопровідність;
-
непрозорість;
-
металічний блиск у твердому стані;
- здатність деформуватись при звичайних і підвищених температурах, не
руйнуючись (пластична деформація).
Найбільшу електропровідність мають срібло, мідь, золото і алюміній.
Найтвердішим металом є хром, його твердість дорівнює 9/10 твердості алмазу, а
найм’якшим – цезій. Залізо удвічі м’якше від хрому.
Температури плавлення і кипіння металів коливаються в широких межах.
Найнижчу температуру плавлення має ртуть (![]() ), а
найвищу – вольфрам (
), а
найвищу – вольфрам (![]() ).
Метали з температурою плавлення вище
).
Метали з температурою плавлення вище ![]() умовно вважають тугоплавкими.
умовно вважають тугоплавкими.
За густиною метали умовно ділять на легкі (![]() ) і
важкі (
) і
важкі (![]() ).
Найлегший метал – літій, він легший від води,
).
Найлегший метал – літій, він легший від води, ![]() , а
найважчий – осмій,
, а
найважчий – осмій, ![]() .
.
За магнітною сприйнятливістю діамагнетиками є
залізо, кобальт і нікель.

