ХІМІЧНІ ВЛАСТИВОСТІ МЕТАЛІВ
Хімічні властивості металів визначаються здатністю їх атомів легко
віддавати свої валентні електрони і перетворюватись на позитивно заряджені
іони:
![]() .
.
Всі метали – відновники і
можуть окислюватись різними окисниками.
Метали можуть взаємодіяти з
простими речовинами. Сполуки металу із Сульфуром називаються сульфідами, з
Нітрогеном – нітридами, з Фосфором – фосфідами, з Карбоном – карбідами, з
Силіцієм – силіцидами, з Бором – боридами, з Гідрогеном – гідридами.
Відновна здатність металів при реакціях у
водних розчинах визначається місцем металу у ряду напруг, де метали розташовані
в порядку зростання їх стандартних електродних потенціалів (![]() , В;
табл. 6). Більш активним є той метал, стандартний потенціал якого менший.
Стандартний потенціал системи
, В;
табл. 6). Більш активним є той метал, стандартний потенціал якого менший.
Стандартний потенціал системи ![]() прийнято рівним нулю. Метал, який розміщений
ближче до початку ряду напруг, і має менше значення стандартного потенціалу, є
активнішим від тих членів ряду, що стоять за ним, і може витісняти їх з водних
розчинів солей:
прийнято рівним нулю. Метал, який розміщений
ближче до початку ряду напруг, і має менше значення стандартного потенціалу, є
активнішим від тих членів ряду, що стоять за ним, і може витісняти їх з водних
розчинів солей:
![]() ;
;
![]() .
.
Потенціал витіснення водню з води
(рН = 7) становить
–0,41 В.
Отже, водень з води можуть витісняти ті метали, потенціал яких менший, ніж –0,41В.
Це метали від початку ряду напруг до заліза включно (![]() ).
Наприклад:
).
Наприклад:
![]()
Проте метали від алюмінію по хром (включно)
захищаються щільною нерозчинною оксидною плівкою і реакція практично не йде.
У кислотах-неокисниках (![]() ,
,![]() (розбавлена),
(розбавлена),
![]() )
окисником є іон
)
окисником є іон ![]() :
:
![]() ,
, ![]() .
.
Тому
метали, потенціал яких менший, ніж 0 вольт, можуть витіснити водень з
цих кислот:
![]() ;
;
![]() .
.
Виняток – свинець, який не витісняє водню з
цих кислот через перенапругу виділення водню на свинці і через нерозчинність
солей. Олово виділяє водень лише з концентрованої хлоридної кислоти:
![]() .
.
В
оцтовій кислоті-неокиснику свинець розчиняється за рахунок окиснення його не іоном
![]() кислоти, а киснем, що є у розчині, з подальшим
утворенням розчинного оцтовокислого свинцю
кислоти, а киснем, що є у розчині, з подальшим
утворенням розчинного оцтовокислого свинцю ![]() .
Водень при цьому не виділяється:
.
Водень при цьому не виділяється:
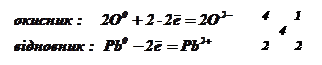
![]()
Кислоти-окисники: ![]() (концентрована) та
(концентрована) та ![]() (будь-якої концентрації) окиснюють аніоном (
(будь-якої концентрації) окиснюють аніоном (![]() ,
,![]() ),
тому при їх взаємодії з металами водень не виділяється. Такі кислоти розчиняють
і ті метали, що стоять після водню в ряду напруг (
),
тому при їх взаємодії з металами водень не виділяється. Такі кислоти розчиняють
і ті метали, що стоять після водню в ряду напруг (![]() ). При
цьому ступінь окиснення окисників
). При
цьому ступінь окиснення окисників ![]() ,
, ![]() змінюється тим сильніше, чим активніший метал,
вища температура і менша концентрація кислоти.
змінюється тим сильніше, чим активніший метал,
вища температура і менша концентрація кислоти.
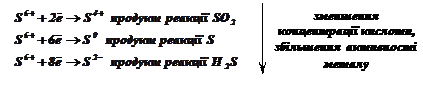 Для
сульфатної кислоти:
Для
сульфатної кислоти:
Для
нітратної кислоти:
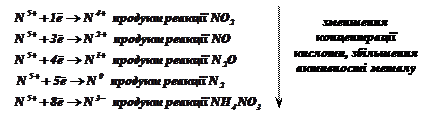
Наприклад:
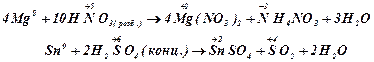
При високій концентрації сульфатної та
нітратної кислот поверхня заліза, хрому пасивується і взаємодія без нагрівання
практично не відбувається.
Суміш нітратної і хлоридної кислоти («царська
горілка») окиснює всі метали, крім компактних осмію, родію та іридію:
![]() ;
;
![]() .
.
З лугами взаємодіють метали, що мають
амфотерні оксиди і гідроксиди (![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() ). При
цьому водень виділяється, якщо метал достатньо активний:
). При
цьому водень виділяється, якщо метал достатньо активний:
![]() ;
;
натрій берилат
![]() ;
;
натрій станнат
Якщо ж метал неактивний, то для його
розчинення в розчині лугу необхідна присутність сильного окисника, водень при
цьому не виділяється:
натрій фольфрамат
![]()

