ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
Реакції, які супроводжуються зміною ступеня
окиснення елементів, називають окисно-відновними (ОВР).
Ступінь окиснення елемента (ст.ок.) – умовний заряд, який обчислюється,
виходячи з припущення, що електронейтральна молекула складається тільки з
іонів. Наприклад: ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() .
.
Зміна ступеня окиснення в хімічних реакціях
зумовлюється зміщенням електронів від одного атома до іншого (повне зміщення у
випадку утворення іонного зв’язку і часткове – коли зв’язок ковалентний полярний).
Наприклад, при взаємодії електронейтральних атомів
натрію і хлору утворюється два заряджених іони: ![]() і
і ![]() :
:
![]()
Втрата електронів – процес окиснення:
![]()
Приєднання електронів – процес відновлення:
![]() .
.
Атоми, молекули або іони, що віддають електрони (збільшують
ст.ок.), називають відновниками (![]() ). У
реакції відновники окиснюються. Атоми, молекули або іони, що приєднують
електрони (зменшують ст.ок.), називають окисниками (
). У
реакції відновники окиснюються. Атоми, молекули або іони, що приєднують
електрони (зменшують ст.ок.), називають окисниками (![]() ). Під
час реакції вони відновлюються.
). Під
час реакції вони відновлюються.
У ОВР число електронів, які віддає відновник,
завжди рівне числу електронів, які приєднує окисник. Процеси окиснення і
відновлення взаємопов’язані.
До типових окисників належать речовини, що мають
виражену тенденцію до приєднання електронів (![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
; ![]() ). При
цьому речовини, до складу яких входять елементи в найвищому ступені окиснення,
можуть виявляти лише окисні властивості:
). При
цьому речовини, до складу яких входять елементи в найвищому ступені окиснення,
можуть виявляти лише окисні властивості:
![]() ;
;
![]() .
.
Речовини, до складу яких входять елементи в
найнижчому ступені окиснення, можуть виявляти в ОВР тільки відновні властивості
(![]() ;
; ![]() ;
; ![]() ;
; ![]() ),
наприклад:
),
наприклад:
![]() ;
;
![]() .
.
Сполуки, до складу яких входять елементи в
проміжному ст.ок. можуть бути і окисниками і відновниками (![]() ;
; ![]() ;
; ![]() ),
наприклад:
),
наприклад:
![]() ,
, ![]() - відновник;
- відновник;
![]() ,
, ![]() - окисник.
- окисник.
Існує два методи складання рівнянь ОВР – метод
електронного балансу і метод напівреакцій. Обидва методи ґрунтуються на умові,
що в ОВР число електронів, відданих відновником, повинно бути рівним числу
електронів, які приєднує окисник.
Складання рівнянь методом електронного балансу. При складанні рівнянь методом електронного
балансу дії виконуються у наступній послідовності:
- записується схема реакції-речовини, що реагують і
продукти реакції;
- виставляються ступені окиснення всіх елементів у
рівнянні, підкреслюються ті, що змінили ступінь окиснення;
- записуються електронні рівняння, які показують
перехід електронів від відновника до окисника;
- складається електронний баланс: число втрачених і
приєднаних електронів повинно бути рівним;
- обчислені при складанні балансу окисно-відновні
коефіцієнти виставляються у рівняння;
- урівнюють метали, неметали, Гідроген, провіряють
за Оксигеном.
Приклад:
![]()
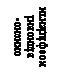 електронні рівняння:
електронні рівняння:
відновник (окиснення) окисник (відновлення)
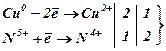
Усі ОВР поділяються на три групи:
1) міжатомного чи міжмолекулярного
окиснення-відновлення, коли окисник і відновник містяться в молекулах різних
речовин:
![]() ;
;
![]() ;
;
![]() ,
,
2) внутрішньомолекулярного окиснення-відновлення,
коли окисник і відновник входять до складу однієї молекули:
![]() ;
;
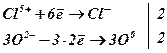
3)
самоокиснення-самовідновлення (диспропорціонування), коли один і той же елемент
виступає і окисником і відновником:
![]() ;
;
![]() ;
;
![]() .
.

