7.5.
Електроліз
Розглянемо процеси, що відбуваються в розчинах електролітів під час пропускання через них електричного струму.
У водних розчинах електроліти дисоційовані на йони, які безладно рухаються.
Якщо у розчин електроліту занурити два електроди та з’єднати їх джерелом
постійного струму, рух йонів стане напрямленим: позитивні йони будуть рухатися до катода, негативні — до анода. Ланцюг замкнеться, через розчин піде електричний струм. Катйони біля катода приєднують електрони, перетворюючись на нейтральні атоми. На катоді відбувається відновлення. Анйони біля анода віддають електрони.
Нааноді протікає процес окиснення. На електродах і в розчині хімічні реакції відбуваються за допомогою електричного струму.
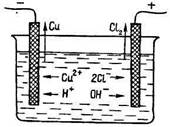 Електроліз розчину хлориду міді (II)
Електроліз розчину хлориду міді (II)
Розглянемо електроліз водного розчину хлориду міді (II) з вугільними електродами. У водному розчині
хлорид міді (II) дисоціює
на йони:
CuCl₂ ⇆![]() + 2
+ 2![]()
Під час пропускання через цей розчин постійного
електричного струму катйони
міді ![]() рухаються до катода, а анйони
хлору
рухаються до катода, а анйони
хлору ![]() – до
анода. На катоді має місце надлишок електронів. Катйони міді захоплюють з
катода електрони, відновлюються та перетворюються на електронейтральні атоми
міді:
– до
анода. На катоді має місце надлишок електронів. Катйони міді захоплюють з
катода електрони, відновлюються та перетворюються на електронейтральні атоми
міді:
![]() +
+ ![]() → Сu.
→ Сu.
Анод заряджений
позитивно. Йони хлору на аноді
віддають електрони, окислюються та перетворюються на електронейтральні атоми хлору, які утворюють молекули:
![]() –
– ![]() →Сl₂
→Сl₂
Катод вкривається червоним шаром міді, а біля анода виділяється газоподібний хлор, який легко визначити за запахом.
Таким чином, під дією електричного струму хлорид міді
(II) розкладається на мідь
і хлор:
![]()
Визначення. Окисно-відновні реакції,
що відбуваються на електродах під час пропускання електричного струму
через розчин або розплав електроліту, називаються електролізом.
Багато факторів (густина струму на електродах, матеріал електродів, природа розчинника, концентрація йонів у розчині та ін.) впливають на процес і кінцеві продукти електролізу.
Процеси, що відбуваються на катоді. Під час електролізу водних розчинів солей металів, які в ряду стандартних електродних потенціалів знаходяться після водню, на катоді виділяється метал:
![]() +
+ ![]() → Сu0;
→ Сu0; ![]() +
+ ![]() → Hg0
→ Hg0
Електроліз водних розчинів солей металів, що в ряду стандартних
електродних потенціалів розташовані перед марганцем (Lі, Nа, К, Rb, Сs, Са, Sr, Ва, Мg, Аl), супроводжуються виділенням водню на
катоді:
![]() +
+ ![]() → Н₂ або 2Н₂O + +
→ Н₂ або 2Н₂O + + ![]() → Н₂ +
→ Н₂ + ![]() .
.
Під час електролізу водних розчинів солей металів, які в ряду стандартних електродних потенціалів знаходяться між алюмінієм і воднем, на катоді одночасно виділяються метал і водень.
Якщо в розчині знаходяться катйони кількох металів, під час електролізу першими відновлюються катйони металу, який має
більші значення електродного потенціалу. Наприклад, під час електролізу розчину, що містить катйони
міді (II), ртуті (II) та срібла, першою буде виділятися ртуть, другим – срібло
і останньою – мідь.
Процеси, що відбуваються на аноді. Аноди бувають нерозчинні
та розчинні. Нерозчинні аноди виготовляють здебільшого з вугілля або платини, розчинні
– з цинку, міді, нікелю та інших металів.
Під час електролізу на нерозчинному аноді відбувається окиснення аніонів кислот або гідроксид-йонів. Так, електроліз
водних розчинів солей безкисневих кислот (НС1, НВr, НІ, НСN, НSСN, Н₂S та ін.) супроводжується окисненням аніонів цих кислот:
![]() –
– ![]() → Cl₂;
→ Cl₂;
![]() –
– ![]() → S.
→ S.
Підчаселектролізуводнихрозчинівсолейкисневміснихкислот (НNO₃, Н₂SO₄, Н₃РО₄ таін.) нанерозчинномуанодівиділяєтьсякисень:
2Н₂O⇆![]() + O₂ +
+ O₂ + ![]() .
.
Електроліз водних розчинів солей на розчинному аноді супроводжується його окисненням:
Ме ⇆![]() +
+ ![]() .
.
Йони металу ![]() переходять
у розчин, анод розчиняється. Наприклад, під час електролізу водного розчину сульфату міді (II) з мідним анодом анод розчиняється,
а на катоді виділяється
чиста мідь:
переходять
у розчин, анод розчиняється. Наприклад, під час електролізу водного розчину сульфату міді (II) з мідним анодом анод розчиняється,
а на катоді виділяється
чиста мідь:
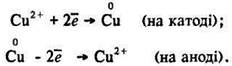
Використання. Електролізвикористовуютьдляодержаннянайбільшактивнихметалів – натрію, калію, кальцію, магнію, атакожалюмініютанайактивнішихнеметалів – водню, фтору, хлору, кисню; лугів – КОНта NаОН.
1834 року Майкл Фарадей встановив закони електролізу. Перший
закон електролізу: маса речовини, що виділяється на якому-небудь електроді
прямо пропорційна величині заряду, який переноситься через електроліт: m=kq (1),
де k −електрохімічний еквівалент,
чисельно рівний масі речовини, що виділяється в
результаті електролізу зарядом в 1 Кл.
Цей закон можна подати і через силу струму – m=kIt.
Другий закон: електрохімічний еквівалент прямо пропорційний
хімічному еквіваленту даної речовини: ![]() , де С −
універсальна стала, чисельно рівна величині,
оберненій до числа Фарадея
, де С −
універсальна стала, чисельно рівна величині,
оберненій до числа Фарадея ![]() ;
; ![]() − відношення атомної маси до валентності.
Отже, другий закон можна подати
− відношення атомної маси до валентності.
Отже, другий закон можна подати![]() (2).
(2).
Виходячи із
(1) та (2) дістанемо формулу об’єднаного закону Фарадея: ![]() .
.
Якщо
масу ![]() , то F=q, тобто
число Фарадея дорівнює величині електричного заряду, який треба перенести через
електроліт, щоб на електроді виділився 1 кг−еквівалент речовини.
Експериментально встановлено, що F=9,65∙107 Кл/(кг-екв.). Приймаючи, що 1 кмоль
речовини переносить заряд, кількісно рівний числу
Фарадея, а кількість частинок в 1 кмолі NA=6,02∙1026кмоль−1,
можна визначити заряд одновалентного йона або
електрона
, то F=q, тобто
число Фарадея дорівнює величині електричного заряду, який треба перенести через
електроліт, щоб на електроді виділився 1 кг−еквівалент речовини.
Експериментально встановлено, що F=9,65∙107 Кл/(кг-екв.). Приймаючи, що 1 кмоль
речовини переносить заряд, кількісно рівний числу
Фарадея, а кількість частинок в 1 кмолі NA=6,02∙1026кмоль−1,
можна визначити заряд одновалентного йона або
електрона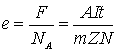 .
.
За допомогою електролізу отримують лужні та лужноземельні метали,
алюміній, водень, кмсень, галогени; очищають одержані
метали (рафінування), вкривають метал шаром іншого металу (нікелювання,
хромування, золочення). Покриття виробів нікелем, хромом, золотом не лише надає їм гарного вигляду, але й запобігає хімічному руйнуванню (корозії).
Електроліз використовують
для зняття точних копій з рельєфних виробів. Копіювання рельєфних виробів за допомогою електролізу називають гальванопластикою. Гальванопластику відкрив російський вчений Б. Якобі (1801 – 1874) у
1837 р.
Приклади розв’язання задач
Задача № 1.
Визначте масу ртуті,
що виділилася під час пропускання постійного електричного струму
силою 5 А через розчин меркурій(ІІ) хлориду протягом однієї години.
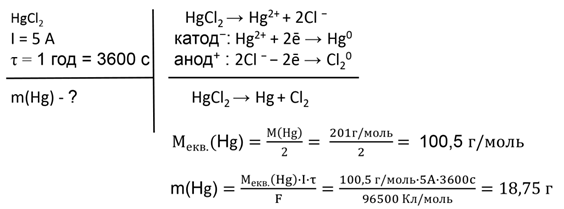
Відповідь: m(Hg) = 18,75 г.
Задача
№ 2.
Визначте силу струму, за якого з розчину аргентум нітрату можна отримати
27 г срібла за 10 хвилин.
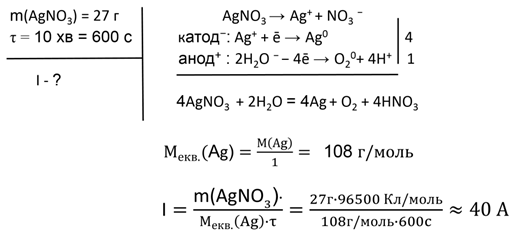
.Відповідь. I = 40 А.
Задача 3. Скласти рівняння ОВР цинку з концентрованою
сульфатною кислотою, яка відновлюється при цьому до найменшого ступеня окислення (+6 ![]() -2).
-2).
Розв’язування: Реакція цинку з концентрованою сульфатною кислотою відбувається
з утворенням сірководню:
Zn + H2SO4 =
ZnSO4 + H2S + H2O
В![]() ідновник: Zn – 2e- =
Zn2+
ідновник: Zn – 2e- =
Zn2+
Окислювач: SO42- + 10H+ – 8e- = H2S
+ 4H2O
4Zn + SO42- +
10H+ = 4Zn2+ + H2S + 4H2O
Рівняннязаписуємоповністю:
4Zn + 5H2SO4 =
4ZnSO4 + H2S + 4H2O.
Задача 4. Визначити, у якому напрямку можливе самодовільне протікання реакції:
Cu + ZnSO4 ![]() CnSO4 + Zn
CnSO4 + Zn
Розв’язування: Визначимо ступінь окислення речовин, які беруть
участь в окислювально-відновному процесі,
окислювач і відновник:
За таблицею стандартних електродних потенціалів атомів у водних розчинах (див. додаток № 2) знаходимо:
Е0 Cu0/Cu2+ =
+1,34 В,
Е0 Zn0/Zn2+ =
-0,76 В.
Для процесу, який протікає
зліва направо:
ΔЕ1°
= Еок.° – Евідн.°
= -0,76-(0,34) = -1,1 В.
Для процесу, який протікає
справа наліво:
ΔЕ2°
= Еок.° – Евідн.°
= 0,34 -(-0,76) = 1,1 В.
Позитивне значення
ΔЕ2° вказує на те, що дана реакція буде самодовільно протікати справа наліво (тобто у даній системі Cu2+ —
окислювач, Zn° — відновник).
Питання для самоконтролю:
1.
Складіть схеми двох гальванічних елементів, в одному
з яких мідь служила катодом, а в іншому – анодом.
2.
Розрахуйте масу срібла, яке виділиться на катоді при
пропусканні струму силою 6А через розчин аргентум
нітрату протягом 30 хвилин.