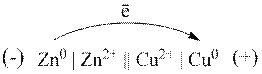7.3. Гальванічні елементи
Окисно-відновні реакції можна
використовувати в техніці. У цьому випадку перехід електронів між
окисно-відновними парами здійснюється по електричному провіднику і є
електричним струмом.
Гальвані́чний
елеме́нт —хімічне джерело живлення, в якому
використовуєтьсярізниця електроднихпотенціалів двох металів, занурених у електроліт. Гальванічний елемент є
непідзарядним хімічним джерелом електроенергії. Явище виникнення електричного струму при контакті різних металів було відкрито
італійськимфізіологом, професором медицини Болонського університету Луїджі Гальвані у 1786 році. Гальвані описав скорочення м'язів
задніх лапок жаби, закріплених на мідних гачках, при дотику сталевого скальпеля.
Спостереження були пояснені першовідкривачем як прояв «тваринної електрики».
Принцип дії. Як правило, такий елемент
складається з двох різних металів, з'єднаних за допомогою сольового містка, а
окремі половини комірки відокремлені одна від одної пористою мембраною. Наприклад,
це може бути цинковий і міднийелектроди,
занурені в розчин сірчаної кислоти. Кожен із електродів зокрема разом із електролітом, в
який він занурений, утворює напівелемент.
На поверхні кожного
з металів, занурених в електроліт, утворюється подвійний електричний шар внаслідок переходу частини атомів металу в розчин у виглядійонів. Як
наслідок, кожен із металів одержує електричний заряд. Якщо з'єднати електроди
провідником, то заряд стікатиме від електрода з більшимпотенціалом, до електрода з меншим потенціалом, утворюючи електричний струм. При цьому потенціали електродів вирівнюватимуться,
що призведе до порушення рівноваги між електродом і електролітом. Це, в свою
чергу, викликає перехід нових атомів із електроду в електроліт. В результаті в замкненому коліпідтримується електричний струм, який супроводжується
розчиненням електродів.
Гальванічний елемент Даніеля – Якобі складається з цинкової пластини,
зануреної у розчин ![]() , та мідної пластини, зануреної у
розчин
, та мідної пластини, зануреної у
розчин ![]() . Розчини електролітів (
. Розчини електролітів ( ![]() ,
, ![]() ) розділяють електрохімічним
ключем, який перешкоджає їхньому змішуванню, але забезпечує можливість переходу
йонів з одного розчину в інший. Якщо
зовнішнє коло розімкнене, цинковий та мідний електроди перебувають у стані
рівноваги:
) розділяють електрохімічним
ключем, який перешкоджає їхньому змішуванню, але забезпечує можливість переходу
йонів з одного розчину в інший. Якщо
зовнішнє коло розімкнене, цинковий та мідний електроди перебувають у стані
рівноваги:
![]()
Внаслідок цього на
них виникають подвійні електричні шари і певні електродні потенціали. Ці
потенціали різні, оскільки здатність віддавати електрони і переходити в розчин
цинку та міді не однакова. Більш здатний до віддавання електронів цинк.Якщо
електроди з’єднати металічним провідником, електрони почнуть переходити з більш
негативного цинкового електрода на мідний. Це спричинює зміщення рівноваги:
![]()
При
замкненому зовнішньому колі в гальванічному елементі окислюється металічний
цинк (утворені йони цинку переходять у розчин), на мідному електроді
відбувається відновлення йонів міді (осаджується металічна мідь).
Сумарне рівняння
окисно – відновної реакції, яка є джерелом електричного струму:
![]()
Внаслідок
перебігу процесів на цинковому електроді катйони ![]() переходять у розчин і створюють у
ньому надлишковий позитивний заряд, а біля мідного розчин, навпаки, збіднюється
на катйони міді
переходять у розчин і створюють у
ньому надлишковий позитивний заряд, а біля мідного розчин, навпаки, збіднюється
на катйони міді ![]() і має негативний заряд (за
рахунок анйонів
і має негативний заряд (за
рахунок анйонів ![]() ). Електричне поле, що
виникає, спричинює рух катйонів розчину (
). Електричне поле, що
виникає, спричинює рух катйонів розчину ( ![]() ) до мідного електрода, а
анйонів (
) до мідного електрода, а
анйонів ( ![]() ) – від мідного електрода до
цинкового. Внаслідок такого переміщення зарядів розчини біля електродів
залишаються електронейтральними.
) – від мідного електрода до
цинкового. Внаслідок такого переміщення зарядів розчини біля електродів
залишаються електронейтральними.
Під час роботи
гальванічного елемента електричний струм у зовнішньому колі створюється
спрямованим рухом електронів, у внутрішньому – йонів.

У
будь – якій електрохімічній системі назви електродів визначають за характером
окисно – відновних процесів, які на них відбуваються.
Анод –
електрод, на якому відбувається процес окиснення і який надсилає електрони в
зовнішнє коло елемента. У гальванічному елементі він має
негативний заряд.
Катод – електрод, на якому відбувається процес відновлення, і який приєднує
електрони. У гальванічному елементі він має позитивний заряд.
Схема роботи
гальванічного елемента Даніеля – Якобі: