4.3.
Способи вираження складу розчинів
Склад
розчину виражають концентрацією розчиненої речовини або часткою розчиненої
речовини (табл. 26). Концентрація розчиненої речовини. Розрізняють такі концентрації
речовини в розчині: молярну, масову, об'ємну. Молярна концентрація розчиненої речовини — це фізична величина,
що визначається відношенням кількості розчиненої речовини до об'єму розчину (див. табл. 2)Наведемо приклади назв розчинів різної молярної
концентрації, моль/л: 1,000 (1М) — молярний; 2,000 (2 М) — двомолярний; 0,100 (0,1 М) — децимолярний;
0,200 (0,2 М) — дводецимолярний; 0,030 (0,03 М) — трисантимолярний
Масова концентрація розчиненої речовини — це фізична величина, що визначається відношенням маси
розчиненої речовини до oб’єму розчину (див. табл.1).
Слід
звернути увагу, що масова концентрація речовини позначається тією ж літерою,
що й густина. У разі розрахунку масової концентрації речовини в
однокомпонентній системі (тобто чистої речовини) ці поняття («масова
концентрація» і «густина речовини») збігаються.
Часто поняття «масова
концентрація» використовують неправильно, маючи на увазі масову частку
речовини в розчині.
Об'ємна
концентрація розчиненої речовини — це фізична величина, що визначається
відношенням об'єму розчиненої речовини до об'єму розчину (див. табл. 1).
Частка
розчиненої речовини. Розрізняють такі частки розчиненої речовини: молярну,
масову та об'ємну. Найбільш вживаною є масова частка.
Таблиця 1. Вираження
складу розчинів
|
Характе- ристика |
Концентрація |
Частка |
||||
|
Моля- рна |
Масова |
Об’ємна |
Молярна |
Масова |
Об’ємна |
|
|
Символ |
c |
ρ |
σ |
χ |
ω |
φ |
|
Вимова |
Це |
Ро |
Сигма |
Хі |
Омега |
Фі |
|
Визна- чальне рівняння |
|
|
|
|
|
|
|
Одиниці вимірю- вання: Cl |
моль· |
кг· |
Безроз- мірні одиниці |
Безроз- мірні одиниці |
Безроз- мірні одиниці |
Безроз- мірні одиниці |
Молярна частка
розчиненої речовини — це
фізична величина, що визначається відношенням кількості розчиненої речовини
до суми кількостей усіх компонентів розчину (див. табл. 1).
Масова частка розчиненої речовини — це фізична величина, що визначається відношенням маси
розчиненої речовини до маси всього розчину (див. табл. 1).
Раніше цю
величину називали процентною концентрацією розчину. Зараз Міжнародний союз з
чистої та прикладної хімії IUPAC
рекомендує замість процентної концентрації розчинів використовувати поняття
«масова частка розчиненої речовини».
Слід
звернути увагу, що ця величина тотожна з масовою часткою речовини в суміші.
Водні
розчини з різною масовою часткою розчиненої речовини мають різну густину.
Об'ємна частка розчиненої речовини — це фізична величина, що визначається відношенням об'єму
розчиненої речовини до суми вихідних об'ємів усіх компонентів розчину (див. табл. 1).
Слід
звернути увагу, що коли сума вихідних об'ємів усіх компонентів розчинів
дорівнює об'єму утвореного розчину, то об'ємна частка тотожна об'ємній
концентрації розчину.
Значення
розчинів. У природі, житті та діяльності людини й усіх живих організмів розчини
мають важливе значення. Адже засвоєння поживних речовин людиною, тваринами,
рослинами пов'язане з процесами розчинення. Усі важливі фізіологічні рідини
(кров, лімфа та ін.) є розчинами. Розчини використовуються в гідрометалургії
для одержання металів, у хімічній промисловості для виготовлення кислот,
лугів, солей, у харчовій промисловості, побуті (приготування їжі, прання,
сангігієна).
Приклади
розв’язання задач
Приклад 1. У 450 г води розчинили 50 г CuSO4*5Н2O. Обчисліть масову частку кристалогідрату та безводної солі у розчині.
Розв'язування:
![]()
![]() Масова частка
Масова частка ![]()
![]()
![]() ,
, ![]() ,
,![]()
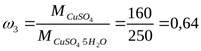 , звідки
, звідки ![]()
Приклад 2. Обчислити: а) масову частку; б) См, Сн,
концентрації розчину
Н3РО4, одержаного при розчиненні 18 г кислоти у 282 см3 води,
якщо густина розчину дорівнює 1,031 г/см5.
Розв'язання:
![]()
![]()
![]()
![]()
![]()
![]() або 0,291 л.
або 0,291 л.
Тоді ![]()
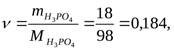
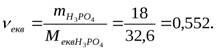
Звідки: ![]()
![]()
Приклад 3. Який об’єм
сульфатної кислоти (густина 1,84 г/см3) і яку масу
води треба взяти для приготування
100 см3 15%-ного розчину
сульфатної кислоти (густина 1,1 г/см3)?
Розв’язання: Обчислимо, скільки чистої кислоти має міститися
у 100 см3 15%-ного розчину:
![]()
![]() Тоді
Тоді
![]()
![]()
Звідки: m(Н20) = m(p-ну
загальн.) – m(p-ну Н2SO4) =
100-17,188 = 92,81 г.
Запитання для самоконтролю:
1. В яких
одиницях виражається концентрація розчинів?
2. Що таке
масова частка?
3. Яке
співвідношення масової і об’ємної частки?