Білки.
1. Будова білків.
Білки ‑ це
макромолекулярні органічні сполуки (біополімери), структурну основу яких
складають поліпептидні ланцюги, побудовані із залишків α-амінокислот. У
побудові білкових молекул беруть участь двадцять α-амінокислот. Кожен білок
має набір амінокислот, сполучених у певній, властивій тільки йому
послідовності. Кількість сполучених у різній послідовності амінокислотних
залишків сягає 1018.
Будова білків дуже складна і зумовлюється не лише послідовністю
амінокислотних залишків. Довгі ланцюги білкових
молекул скручуються у спіралі,
спіралі – у клубки, що певним чином розміщуються у просторі.
Розрізняють первинну, вторинну, третинну й четвертинну
(для деяких білків)
структуру.
Таблиця 3.
Структура білків
|
Структура |
Чим визначається |
|
Первинна |
Послідовністю амінокислот
у ланцюзі. |
|
Вторинна |
Формою ланцюга
(α-спіраль). |
|
Третинна |
Просторовою структурою ланцюга. |
|
Четвертинна |
Асоціацією кількох поліпептидних ланцюгів у комплекси. |
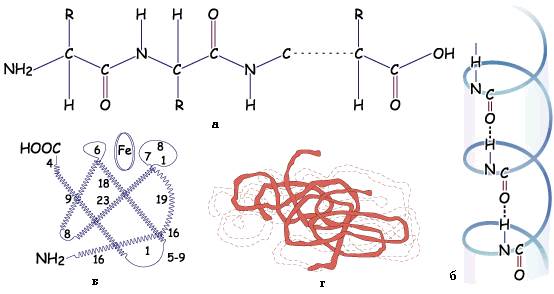
Рис. 2. Структура білка:
а, б, в - відповідно первинна, вторинна, третинна структури міоглобіну
(цифри ‑ число амінокислотних залишків у молекулі); г ‑ четвертинна структура гемоглобіну
2. Властивості білків.
Білки дуже різняться між собою за властивостями, оскільки містять залишки амінокислот з різними
функціональними групами, здатними вступати в характерні для них реакції.
Одні білки розчинні, інші — ні. Багато білків
утворюють колоїдні розчини. Білки мають різний смак, колір і запах. Температури, за яких відбувається руйнування білка, специфічні для кожного з них.
Хімічні властивості білків.
Білки, як і амінокислоти, є амфотерними
сполуками зі слабко вираженими основними та кислотними властивостями.
1. Денатурація. У результаті
нагрівання білка відбувається його денатурація (втрата природних якостей). При цьому руйнується складна
структура білка, що призводить до втрати ним біологічної активності. Це необоротний процес, він відбувається,
наприклад, під час кулінарної обробки м'яса, риби, яєць.
Чинники, що викликають денатурацію білків:
‑ нагрівання;
‑ випромінювання, наприклад інфрачервоне або ультрафіолетове;
‑ сильні кислоти,
сильні луги, концентровані розчини солей (у разі тривалої дії
розриваються навіть пептидні зв’язки);
‑ важкі метали;
‑ органічні розчинники
(використання спирту як дезінфікуючого засобу базується на тому, що він
викликає денатурацію білків бактерій).
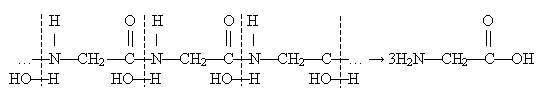
2. Гідроліз. Під
дією кислот, лугів, ферментів відбувається розщеплення полімерної білкової
молекули на амінокислоти. Молекули води приєднуються за місцем пептидних зв'язків, останні руйнуються, замість пептидних груп утворюються аміно- й карбоксильні групи.
3. Розкладання. Під дією мікроорганізмів
білки розкладаються з утворенням амоніаку, сірководню, фенолу, інших речовин з неприємним запахом. Його поява засвідчує,
що відбувається процес розкладання (гниття) білка.
4. Якісні кольорові реакції. Для аналітичного
виявлення використовують кольорові реакції білків. Поява жовтого
забарвлення в результаті
реакції з концентрованою нітратною кислотою
засвідчує наявність
бензенових ядер у структурі
білка (ксантопротеїнова реакція).
Червоно-фіолетове забарвлення білка в результаті дії купрум (ІІ)
гідроксиду засвідчує наявність пептидних зв'язків (біуретова реакція).
3. Біологічне значення амінокислот
і білків.
Білки є основним будівельним матеріалом тваринних організмів, а саме їх клітин. Білки
їжі безпосередньо не засвоюються організмом, спершу вони гідролізують до амінокислот, останні всмоктуються у кров, нею переносяться
до печінки, де організм синтезує білки, властиві саме йому.
Для нормального функціонування організму
необхідно постійно поповнювати запас амінокислот переважно за рахунок білків їжі.

