Фенол.
1. Склад і будова молекули фенолу.
У разі,
коли гідроксильна група сполучена безпосередньо з бензольним ядром, утворюється сполука фенол, представник
класу фенолів. Молекулярна формула С6Н5—ОН,
структурна формула:
2. Фізичні властивості фенолу.
Фенол — низькоплавна речовина. Фенол — кристалічна
речовина, безбарвна, має характерний запах. У разі зберігання в нещільно закритому посуді внаслідок окиснення набуває рожевого кольору (t°пл>42°С).

Якщо пробірку з фенолом помістити у посудину з
гарячою водою: речовина розплавиться. У холодній воді
фенол розчиняється погано. Але якщо
додати у пробірку з фенолом гарячої води, спостерігатиметься його швидке розчинення.
3. Хімічні властивості фенолу.
Фенол – хімічно активна сполука, причому підвищену реакційну здатність
мають і гідроксильна група, і бензенове кільце. За наявністю в молекулі фенолу гідроксильної групи можна припустити
подібність між фенолом і спиртами.
Горіння фенолу
C6H5-OH
+ 7О2 → 6СО2 + 3Н2О
Карбон (ІV) вода
оксид
Реакції за участю гідроксильної
групи. На відміну від спиртів фенол виявляє кислотні
властивості (раніше фенол називали карболовою кислотою). Однак сполука дисоціює
у розчині дуже слабо
C6H5OH ↔
H+ + C6H5O‑
і не змінює
забарвлення індикаторів.
Реакції
з металами. Фенол, нагрітий до початку плавлення, взаємодіє з лужними
металами з виділенням водню.
2C6H5OH + 2Na → 2C6H5ONa + Н2↑
Натрій фенолят
Реакції з лугами. Фенол,
на відміну від спиртів, як слабка кислота взаємодіє з водними розчинами лугів з
утворенням солей – фенолятів:
2C6H5OH + 2NaОН ↔ 2C6H5ONa + Н2О
Натрій фенолят
Якщо у водний розчин натрій феноляту пропустити вуглекислий газ, то
виділяється фенол:
C6H5ONa + СО2
(надл.) + Н2О → C6H5OH + NaНСО3
Отже, фенол – більш слабка кислота, ніж
карбонатна.
Якісна
реакція на фенол. При добавлянні до водного розчину фенолу жовтувато-бурого
розчину феруму (ІІІ) хлориду з’являється фіолетове забарвлення. Хімічне
рівняння зі спрощеною формулою продукту реакції:
3C6H5OH + FeCl3 → (C6H5O)3Fe + 3НCl
Ферум(ІІІ) фенолят
Реакції за участю бензенового кільця.
Гідроксильна група активує бензенове кільце молекули фенолу й сприяє
заміщенню атомів гідрогену.
Реакції з галогенами. Фенол,
на відміну від бензену, реагує з бромною водою, відбувається реакція заміщення (бромування) з утворенням
білого осаду трибромфенолу:
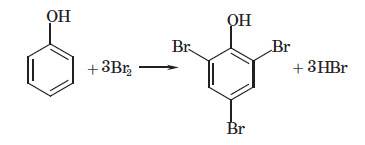
Ця реакція також є якісною на фенол.
Реакції нітрування. Фенол
взаємодіє з розбавленою нітратною кислотою за звичайних умов з утворенням
суміші нітрофенолів.
Отже, взаємний вплив бензенового кільця
і гідроксильної групи в молекулі фенолу зумовлює кислотні властивості сполуки
та полегшує перебіг реакцій заміщення в бензиновому кільці (порівняно з
бензеном).
4. Добування.
Фенол добувають із кам’яновугільної
смоли, а також із продуктів крекінгу нафти – бензену і пропену. Один із
промислових методів добування фенолу ґрунтується на реакції хлорування бензену
з наступною взаємодією хлорбензену з концентрованим водним розчином лугу (за
нагрівання і підвищеного тиску).
![]()
5. Застосування фенолу.
Фенол було вперше
виділено з кам'яновугільної смоли в першій половині XIX ст. Його застосування тісно пов'язане з розвитком
синтетичної органічної хімії. Фенол є вихідною речовиною для виробництва барвників, лікувальних препаратів, пластичних мас, вибухових речовин.
Фенол має
антисептичні властивості, які були виявлені
ще у другій половині XIX ст. Вони зумовлюють використання його розчину (5 %-го) для знезаражування приміщень,
хірургічних інструментів, його добавляють до деяких сортів мила, ним протравлюють деревину, щоб запобігти її гниттю.
Разом з
тим це токсична речовина, що може
спричинити опіки шкіри. Оскільки фенол є продуктом коксохімічної промисловості, то вкупі з іншими промисловими
викидами він потрапляє у стічні води, тим самим забруднює навколишнє середовище.

