Спирти.
1. Будова молекул, класифікація, номенклатура.
Органічні сполуки, що містять у своєму
складі атоми Оксигену, називаються оксигеновмісними.
Оксиген зазвичай входить до складу органічних
сполук у формі груп атомів. Такі
групи атомів називають функціональними групами.
Функціональні групи — це
групи атомів, що визначають хімічні й фізичні властивості речовин.
Наприклад,
‑OH — гідроксильна група;
‑COH — карбонільна;
‑COOH — карбоксильна.
До складу сполук може входити
одна або кілька функціональних груп (однакових або різних).
Органічні речовини, молекули яких містять
одну або кілька функціональних гідроксильних груп, з’єднаних з вуглеводнями, називаються спиртами.
Загальна формула спиртів: R ‑ (OH)n.
Спирти класифікують за різними структурними ознаками.
За числом гідроксильних груп спирти поділяються
на такі:
• одноатомні (одна група -OH);
• багатоатомні (дві й
більше груп -OH).
Залежно від того, з яким атомом Карбону зв’язана гідроксигрупа, розрізняють спирти:
• первинні R ‑ CH2 ‑ OH;
• вторинні R2CH ‑ OH;
• третинні R3C ‑ OH.
Наприклад:
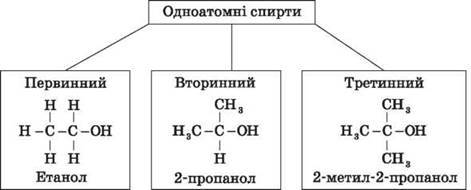
За будовою радикалів,
пов’язаних з атомом
Оксигену, спирти поділяються на такі:
• насичені, або алканоли
(CH3CH2 ‑ OH);
• ненасичені, або алкеноли
(CH2 = CH ‑ CH2 ‑ OH);
• ароматичні (C6H5CH2 ‑ OH).
Систематичні назви даються за
назвою вуглеводню з додаванням суфікса
-ол і цифри,
що вказує положення гідроксигрупи (за необхідності). Нумерацію
карбонового скелета починають з
того краю, до якого ближче перебуває гідроксильна група. Наприклад:
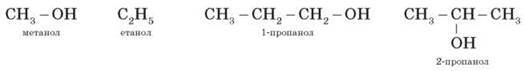
Цифру, що відбиває місце
розташування ОН-групи, в англомовній літературі ставлять перед назвою головного ланцюга: 2-метил-1-бутанол. Проте,
правила IUPAC дозволяють ураховувати
особливості національної мови. Наприклад, у російськомовних виданнях ця цифра зазвичай ставиться після суфікса -ол. Це розвантажує
словесну частину назви від цифр (наприклад, 2-метилбутанол-1).
Іншим способом (радикально-функціональна номенклатура) назви
спиртів складають від назв радикалів
з додаванням слова «спирт».
Відповідно до цього способу
наведені вище сполуки називають: метиловий спирт, етиловий спирт, н-пропіловий спирт, ізопропіловий
спирт.
2. Фізичні властивості спиртів.
Нижчі спирти є рідинами з відносно високою температурою кипіння
(температура кипіння метанолу ‑ +64,5 °С). У переході від одноатомних до багатоатомних спиртів або фенолів температури
кипіння й плавлення різко зростають.
Здатність розчинятися у воді зменшується зі збільшенням вуглеводневого
радикала й від багатоатомних гідроксисполук до одноатомної. Метанол, етанол,
пропанол, ізопропанол, етиленгліколь і гліцерин змішуються з водою в будь-яких співвідношеннях.
3. Ізомерія спиртів.
Для спиртів є характерною структурна ізомерія:
• ізомерія положення ОН-групи (починаючи із С3); наприклад:

• карбонового скелета (починаючи із С4); наприклад, формулі C4H9OH відповідають
чотири структурні ізомери:
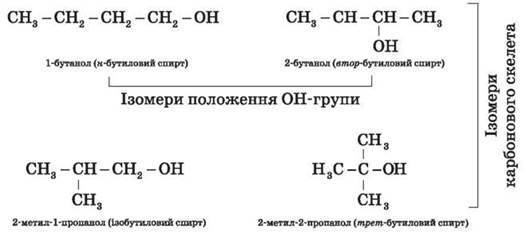
• міжкласова ізомерія з етерами;
Наприклад,
етиловий спирт CH3CH2‑OH і диметиловий
етер
CH3 – O ‑
CH3.
Можлива також просторова ізомерія — оптична.
4. Насичені одноатомні спирти.
Загальна формула насичених
одноатомних спиртів – CnH2n+1OH. Відповідний
гомологічний ряд сполук починається з метанолу ‑ CH3OH
(метиловий спирт).
C2H5OH – етанол
(етиловий спирт).
а) фізичні властивості
насичених одноатомних спиртів;
Метанол і етанол за нормальних
умов — рідини, легші за
воду, мають специфічний
запах, як полярні, сполуки,
вони добре розчинні у воді
метанолу дорівнює 65 °С, етанолу
‑ 78 °С.
Метиловий спирт ‑ дуже отруйна рідина, у разі потрапляння в організм 10 мл метанолу спричинюють
сліпоту, а 25 мл ‑ смерть.
Етиловий спирт за дією на організм є наркотиком, що в невеликих
дозах спричинює сп'яніння,
у великих ‑ навіть смерть. Зловживання
напоями, що містять етанол (інакше алкоголь), викликає страшне захворювання ‑ алкоголізм.
Метанол і етанол ‑ дуже подібні рідини, розрізнити їх можна
лише хімічним способом або за температурою кипіння. Трапляються випадки, коли люди помилково вживають метанол замість етанолу, що призводить до трагічних
наслідків.
б) хімічні властивості метанолу й
етанолу.
Реакції окиснення.
а) повне окиснення (горіння):
Спирти, як і всі органічні сполуки,
горять. Метанол і етанол миттєво спалахують при підпалюванні й горять синюватим,
майже непомітним полум'ям із виділенням
великої кількості теплоти. Відбувається реакція повного окиснення:
С2Н5ОН + 3О2 → 2СО2
+ 3Н2О
б) часткове окиснення:
Спирти окиснюються до альдегідів, які
далі перетворюються на карбонові кислоти:
+[O] +[O]
С2Н5ОН → СН3CОН → СН3CОOН
спирт альдегід кислота
Реакції з металами.
Спирти взаємодіють із лужними металами
з виділенням водню й утворенням солеподібних сполук – алкоголятів:
2С2Н5ОН + 2Na → 2С2Н5ONa + Н2↑
Реакції з галогеноводнями.
Спирти взаємодіють із хлороводнем,
бромоводнем, йодоводнем. При цьому гідроксильна група в молекулі спирту
заміщується на атом галогену:
С2Н5ОН + HBr ↔ С2Н5Br + Н2О
бромоетан
Реакції дегідратації.
Спирт при нагріванні з надлишком
концентрованої сульфатної кислоти (або безводної ортофосфатної кислоти)
перетворюється на алкен:
С2Н5ОН → CH2=CH2 + Н2О
етанол етен
Відщеплення молекули води від молекули сполуки називають внутрішньомолекулярною дегідратацією.
Нагрівання спирту з невеликою кількістю
кислоти призводить до відщеплення молекули води від кожних двох молекул спирту
й утворення етеру:
С2Н5ОН + С2Н5ОН → С2Н5‑О‑С2Н5 + Н2О
діетиловий
етер
Це – міжмолекулярна дегідратація.
в) добування;
Метиловий спирт був уперше добутий у XVII ст., а вивчений
у першій половині XIX ст. Його називають ще деревним
спиртом за першим із відомих
методів добування, а саме шляхом сухої перегонки деревини.
Етиловий спирт, етанол,
винний спирт, алкоголь ‑ назви-синоніми
однієї сполуки, що є основою алкогольних
напоїв і найвідоміша із класу спиртів. Перша літературна згадка про власне етиловий спирт як «горючу воду», добуту перегонкою
вина, відноситься до VIII ст., а елементний
склад етанолу було з'ясовано на початку ХІХ ст.
Етиловий спирт добувають двома
методами. Сучасний метод
ґрунтується на реакції етену з водяною парою за температури 300 °С, підвищеного
тиску і наявності каталізаторів:
CH2=CH2 + Н2О → С2Н5ОН
Основою іншого методу є біохімічний
процес – спиртове бродіння глюкози за участю ферментів дріжджів:
С6Н12О6 → 2С2Н5ОН + 2СО2↑
Цей процес використовують із давніх часів для виготовлення вина із
винограду, інших ягід і фруктів.
Сировиною для виробництва спирту, що йде на потреби харчової промисловості,
є пшеничний або картопляний крохмаль, а технічного
спирту – целюлоза, добута із відходів переробки деревини.
г) застосування метанолу й етанолу.
Метанол і етанол ‑ розчинники.
Ця їхня властивість
використовується в органічному
синтезі та лабораторній практиці. Етанол як розчинник застосовується у фармації, медицині (екстрагування, виготовлення настоянок тощо), харчовій промисловості.
За допомогою
хімічних перетворень із цих спиртів
добувають речовини, що є вихідними
для виробництва пластмас і каучуку.
Етанол використовується
для синтезу оцтової кислоти,
у суміші з бензином ‑ як пальне.
3. Багатоатомні спирти.
Найпростішим двохатомним спиртом є етиленгліколь
НО‑СН2‑СН2‑ОН, а трьохатомним спиртом –
гліцерин
НОСН2‑СНОН ‑СН2ОН. У природі немає цих
сполук, але похідні гліцерину – жири – дуже поширені в ній.
Фізичні властивості. Етиленгліколь і
гліцерин – безбарвні в’язкі рідини, солодкі на смак. Вони не мають запаху,
гігроскопічні, трохи важчі за воду, змішуються з нею в будь-яких
співвідношеннях з утворенням розчинів. На відміну від гліцерину етиленгліколь є
токсичним.
Хімічні властивості.
Багатоатомні спирти та їх розчини не
змінюють забарвлення індикаторів.
1.
Окиснення. Етиленгліколь і гліцерин горять на повітрі з утворенням
вуглекислого газу і води.
2.
Реакції заміщення з активними
металами й із деякими гідроксидами металічних елементів.
3. У реакціях з
галогеноводнями відбувається заміщення
гідроксильних груп гліцерину на галоген.
4. Характерною (якісною) реакцією гліцерину є
утворення розчину синього кольору (Купрум (ІІ) гліцерат) з Купрум (ІІ)
гідроксидом.
Застосування гліцерину. Етиленгліколь є вихідною речовиною для
синтезу деяких органічних розчинників, у виробництві синтетичних волокон
(лавсану). Температури замерзання водних розчинів етиленгліколю значно нижчі,
ніж води. Тому їх застосовують узимку для охолодження двигунів в автомобілях;
назва таких рідин – антифризи.
Гліцерин — продукт, що має широке застосування. Завдяки гігроскопічності він використовується в парфумерії та фармації як зм'якшувальний засіб або основа мазей, добавка
до мила, у харчовій промисловості
— як добавка до напоїв. У шкіряному
виробництві та текстильній промисловості — для обробки пряжі і шкіри
з метою їх пом'якшення та надання еластичності. З гліцерину добувають вибухову речовину нітрогліцерин, що використовується для виготовлення динаміту Спиртовий розчин нітрогліцерину має судинорозширювальну дію й у вигляді ліків
використовується при серцевих
захворюваннях.

