ЛАБОРАТОРНА РОБОТА 5
ВИДІЛЕННЯ І
КУЛЬТИВУВАННЯ В УМОВАХ IN VITRO
АПІКАЛЬНИХ МЕРИСТЕМ
КАРТОПЛІ
МЕТА:
Оволодіти методиками виділення та культивування апікальних меристем
картоплі в умовах in vitro
МАТЕРІАЛИ І УСТАТКУВАННЯ: бульби картоплі різних сортів; бінокулярна
лупа або мікроскоп біологічний порівняльний; стерилізовані скальпелі,
препарувальні голки, бритвочки, затиснуті в держаки;
пробірки із стерильним поживним середовищем для культивування апікальних
меристем картоплі (дод. табл.13); спиртівка;
сірники; 96%-й спирт у фарфоровому стаканчику.
Теоретична частина
В залежності від виду і розміру тканини
методи культури тканин бувають: сіянцеві; вегетативні; калусу;
протопласта; соматичних ембріонів.
В практичному застосуванні найбільшого
поширення набув метод вегетативного мікророзмноження
при якому в якості вихідного матеріалу є довільна вегетативна частина
рослини. При цьому методі розмноження
найчастіше застосовують:
- культуру
верхівкової (апікальної) меристеми яка передбачає
використання в якості вихідного матеріалу звичайних верхівкових (апікальних)
меристем, котрі в подальшому використовуються для репродукції нових поколінь.
Це означає, що апікальна меристема відділяється від материнської рослини і
продовжує розвиватися в асептичних умовах як мініатюрний пагін (живець).
Апікальна меристема і сама верхівкова сферична її частина із зачатковими
листками зазвичай є вільною від вірусів навіть у системно інфікованих рослин.
Репродукція нових рослин з верхівкової
меристеми використовується для отримання оздоровлених (вільних від патогенів)
рослин для їх промислового розмноження. Весь процес оздоровлення рослин
включає термотерапію, яка буває
двох видів:
- короткочасна (1,5 - 4,0 год.)
проводиться нагрівання всієї рослини до
темпе-ратури 44 - 57°С шляхом занурення всієї рослини
або її частини у воду чи перенесення в термостат для знищення грибів, вірусів і нематод.
- тривала - (2 - 3 тижні) вся рослина
поміщається в умови помірно підвищених температур (37
- 38°С). В таких умовах віруси не знищуються проте ефективно імобілізуються (стають нерухомими). За час прогрівання
верхівкова меристема продовжує рости і таким чином новоутворений приріст є
вільним від патогенів. Кожна з цих верхівкових меристем і буде вихідним
матеріалом для отримання оздоровлених рослин. Проте, ніколи ми не можемо
напевно стверджувати, що отримана таким чином меристема є вільною від
внутрішніх патогенів. Для цього існують методи виявлення патогенів у рослинах:
- візуальна
інспекція. Часто про наявність патогенів у рослині можна судити по
характерних змінах у формі і забарвленні листя, пагонів і плодів;
- ідентифікація
по культурі тканин. Після поверхневої стерилізації експлант
поміщають у середовище, сприятливе
для розвитку патогенів, які
згодом можна виявити візуально або
шляхом проведення біохімічних тестів;
- ідентифікація вірусів - найстаріший
спосіб виявлення латентних форм вірусів у
рослинах. Проводиться шляхом
щеплення або окулірування
досліджуваної рослини на рослину-індикатор, у якої при наявності вірусів
формуються характерні ознаки;
- серологічний тест - дозволяє ідентифікувати
будь-які віруси, шляхом
виявлення унікальних для кожного виду патогенів протеїнів (білку), проведення
автоматизованого тесту ЕЛISА. Суть якого полягає у введенні
досліджуваної субстанції у кровоносну систему кролика, де при наявності вірусів
виробляються специфічні антитіла. Після забору крові фракція сиворотки містить ці антитіла, наявність або відсутність
яких підтверджується проведенням тесту.
Метод культури верхівкової меристеми
застосовується для масового розмноження, проте лише отримані з них рослини,
після підтвердження їх безвірусного статусу є джерелом вихідного матеріалу для
прискореної мультиплікації клонів.
Культура
латеральної (аксилярної) меристеми - найбільш поширений метод масового розмноження рослин в культурі
тканин. Вихідним матеріалом для ініціації культури є будь яка частина рослини,
яка є найбільш готовою для активного росту, найменш ураженою і найбільш
генетично стійкою. Такою частиною є латеральні (бічні) пагони і пазушні (аксилярні) бруньки. На відміну від апікальних меристем вони
є більш генетично стійкими і менше піддаються мутаціям.
Метод мікроклонального
розмноження грунтується на індукованому фітогормонами
розростанні верхівкових та пазушних меристем, кожна з яких започатковує
осередок пагонів. Після формування такого осередку його поділяють на дрібніші
групи пагонів, переносять на свіже середовище, і
процес повторюється. Швидкість мікроклонального
розмноження залежить від виду і, навіть, сорту або лінії рослини, але часто
можливо отримувати із окремої бруньки до кількох мільйонів рослин за рік.
Залежно від характеру морфогенетичних процесів (способів одержання
рослин-регенерантів) в культурі тканин розрізняють типи (методи) мікроклонального розмноження, в основі яких лежать
відмінності одержання рослин (з уже існуючих у рослин in vitrо або новоутворених in vitro ініціалей).
Перший
тип рослин утворюється внаслідок активації існуючих в інтактній рослині
меристем (апекс стебла, пазушні і сплячі бруньки стебла), тобто шляхом прямого
морфогенезу. Ці рослини, регенеровані з меристем, генетично ідентичні
батьківським формам.
Другий
тип рослин утворюється в результаті індукції виникнення бруньок або ембріоїдів. Ці рослини, отримані зі спеціалізованих
і калусних клітин, яким властива генетична
мінливість, нерідко відрізняються від батьківських. Цей метод застосовується
до рослин, у яких калюс відрізняється генетичною стабільністю і коли
варіабельність між рослинами-регене-рантами не
перевищує рівня природної мінливості.
Вважається, що утворення
рослин-регенерантів безпосередньо з експланта (шляхом
активації існуючих меристем, утворення бруньок чи ембріоїдів)
характеризує прямий морфогенез. Активація росту пазушних бруньок і використання пазушних пагонів -
найпоширеніший тип мікрокло-нального розмноження
рослини. На рослині в умовах in vitro ріст пазушних
бруньок пригнічується апікальним домінуванням, а ріст пазушних меристем
стимулюється видаленням верхівки стебла або обробкою цитокінінами. Введення в живильне середовище цитокінінів
пробуджує бічні бруньки і спричинює розвиток численних нових бруньок, так
званих розеток бруньок. Утворюється пучок пагонів, що швидко росте, його
розділяють на дрібніші пучки із загальною кореневою системою або на окремі
пагони, які спроможні утворювати під час вирощування на свіжому живильному
середовищі такі самі пучки (розетки) бруньок і пагонів.
Культивування
тканин стебла з пазушними бруньками на живильному середовищі призводить до
утворення нормального пагона, який формує рослину.
Для прискореного розмноження перший пагін після формування 5 - 7 листків
розділяють на живці завдовжки 1,0 -
Методом індукції
пазушних бруньок у культурі тканини розмножують плодово-ягідні і декоративні
культури, капусту, картоплю і багато інших. Він гарантує максимальну генетичну
однорідність рослин – регенерантів. Розмноження рослин пазушними пагонами є
найповільнішим шляхом із відомих типів органогенезу.
При мікророзмноженні
- живцюванні використовують придаткові пагони. Метод ґрунтується на здатності
рослин утворювати пагони безпосередньо із спеціалізованих тканин експланта. Окремі клітини ізольованих тканин рослин дедиференціюються з наступним утворенням меристемних осередків, в яких закладаються стеблові бруньки
(спостерігається гемогенез). Розвиток адвентивних
(придаткових) пагонів проходить за рахунок бічних і інтеркалярних
меристем, внаслідок чого новоутворені рослини генетично ідентичні батьківській
формі. В утворених меристемних осередках
культивованого експланта процес диференціювання іноді
спрямовується шляхом формування ембріоїдів. Цей тип
регенерації характерний для трав'янистих рослин у разі використання як експлантів фрагментів листків, лусок, цибулин,
бульбоплодів, стебел, кореневищ тощо.
Часто в прискорених циклах культивування
з метою запобігання зниженню активності регенерації і появи мінливості у
регенерованих пагонів використовують для регенерації калусну
тканину, яка виникає на експланті на місці зрізу (первинний
калюс). У цьому випадку утворення коренів у регенерованих пагонів часто
відбувається спонтанно при перенесенні їх на середовище без цитокінінів.
Отримані рослинки розглядають як невеликі укорінені живці. Вважається, що така
система мікророзмноження володіє найменшим ризиком
для виникнення генетичних порушень і, порівняно з традиційними методами, цей
шлях розмноження значно економить час, необхідний для отримання посадкового
матеріалу, і виробничі площі, збільшуючи багатократно коефіцієнт розмноження.
Крім фруктових, винограду та квіткових культур цю систему застосовують для
розмноження ягідних та овочевих, наприклад, малини, суниць, чорниць, люцерни,
цукрових буряків, капусти, томатів, тютюну та багатьох інших.
Отже, не тільки кожному виду рослин, а й
навіть окремим тканинам властива конкретна морфогенетична
реакція, що використовується для мікроклонального
розмноження в культурі in vitro із забезпеченням генетичної
стабільності у межах нормальної спонтанної мутабільності
рослин.
Мікроклональне розмноження включає 4 етапи, кожен з яких має свою чітку мету:
ініціація культури; мультиплікація пагонів; укорінення та дорощування.
Стадія 1 - ініціація культури. Перший етап мікроклонального
розмноження рослин або їх частин розпочинається з перенесення частини тканини
рослини (експланта) в спеціальні умови для його
подальшого розвитку. Він складається з чотирьох завдань:
- вибір місця відбору вихідної тканини (експланта);
- дезинфекція експланта;
- розміщення експланта
на середовище;
- стабілізація культури.
Вибір меристемної рослини.
Бажано, щоб вихідні рослини не були ушкоджені
грибними, бактеріальними і вірусними хворобами. Цибулини, кореневища і бульби
перед введенням у культуру іп vitro попередньо обробляють високими або низькими
температурами протягом різного часу - від кількох годин до кількох місяців.
Першим рішенням, котре слід прийняти є вибір найбільш придатної
для розмноження частини рослини з якої береться експлант.
В переважній більшості випадків цією частиною є пазушна брунька або бічний
пагін, хоч у випадку з рослинами родини папоротей вихідною тканиною буде
частина столона. Розмір вихідної тканини (експланта)
зазвичай є дуже малим (довжиною 1-
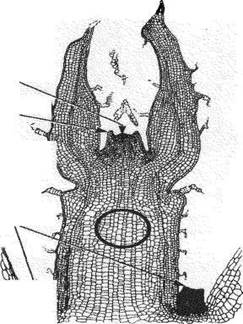
Апікальна меристема
Зачатки листка
Аксилярні (бічні)
меристеми
Рисунок 4.1. Конус наростання в
рослині
Вибравши відповідну вихідну частину
материнської рослини для подальшого розмноження, відділяють необхідну частину
відповідного розміру і проводять її поверхневу дезинфекцію
(стерилізацію). Поверхнева дезинфекція
це процес видалення забруднення (вірусів, бактерій, грибів тощо) тільки з
поверхні рослинного матеріалу, а не з внутрішньої її частини. Вона перед-бачає застосування хімічних
речовин, котрі є токсичними для мікроорганізмів і нешкідливими для рослини.
Основні дезинфектанти місять алкоголь (80-90% спирт):
етил, метил, ізопропіл або хлорвмісні
відбілювачі (хлорид кальцію, гіпохлорид
натрію в концентрації 5 - 6% активного компонента). Перед застосуванням відбілювач розбавляють до концентрації у 10 - 20% і додають кілька крапель ПАР
(поверхнево-активних речовин: Сільвет, Citowet, Agral, SuperAm…).
Підготовлену частину рослини переносять у стерильну посуду (чашку Петрі). Використовуючи
простерилізований (вмочені у спирт і пропалені на вогні спиртівки робочі
частини) інструмент (скальпель та пінцет) експлант
подрібнюється на частини, які переносяться на поживне середовище.
Кількість експлантів
в одній посудині залежить від культури і розміру посуди (картопля - 1,
суниця - 4 і більше).
Після висадки експлантів
на середовище, пробірки закривають і герметизують. Цю роботу проводять в
лабораторних умовах під спеціальною витяжкою із зворотньою
подачею повітря, яке попередньо проходить через надтонкий фільтр, який вловлює
бактерії, спори та інші патогени. Контейнери з тканинами поміщають в умови регульованого середовища. Основними параметрами якого є:
Температура. Більшість лабораторій дотримуються практики підтримування
постійної температури +20...+27°С. Однак, для оптимального розвитку окремих
культур (формування бульбочок у лілій) необхідно знижувати температуру протягом
нічного циклу. Температура є визначальним фактором для гальмування
інтенсивності росту культур.
Світло впливає на ріст і розвиток рослин
шляхом світлового випромінювання (ФАР), тривалості (фотоперіоду) та спектру.
Інтенсивність світлового випромінювання для мікророзмноження
коливається в межах 40-80 y тmol х m2 х sec1 на рівні експлантів. Оптимальними
умовами розвитку є 16 годинний світловий день і 8-ми годинний нічний цикл.
Шляхом зміщення співвідношення «день – ніч» можна штучно
викликати фізіологічні зміни: якщо у гвоздики тривалість дня становить 16 годин
то вони будуть ут-ворювати квітки, при 12 годинному
світловому дні вони будуть лише рости.
Для освітлення використовуються
флуоресцентні лампи з білим денним світлом
спектр яких становить 400-800 нм. Світло різного спектру впливає на
органогенез: червоний спектр сприяє росту пагонів (у герані), голубий пригнічує
їх ріст та галуження, стимулюючи утворення хлорофілу і збільшення площі
листкової поверхні (у берези). Червоний та інфрачервоний - сприяють утворенню
бульб у тюльпанів та покращують укорінення фікуса та фрезії
в порівнянні із застосуванням голубого спектру. Встановлено, що висока
інтенсивність освітлення пригнічує коренеутворенрення.
Газовий склад повітря. Оптимальний вміст вуглекислого газу в повітрі - 0,3 – 5,0% концентрації, який у більшості
культур сприяє інтенсивному росту і
укоріненню.
В таких умовах експлант
проходить такі етапи:
- фаза
ізоляції. Після висаджування експланта на
середовище, відбува-ється інтенсивний
його ріст за рахунок власних
тканин;
- фаза стабілізації. Під час її
проходження можуть відбуватися відхилення
росту і розвитку культури (недостатнє галуження, нерівномірний ріст
пагонів). При успішній стабілізації культури вона добре
росте, утворюючи достатню
кількість однакових за розміром пагонів.
Завершення першого етапу мікророзмноження наступає через 4 - 6 тиж-нів,
коли вільні від інфекції культури утворюють кілька однакових пагонів.
Пересаджування вкорінених рослин в
культиваційні споруди краще проводити у кінці травня, приживання яких у цьому випадку є
найвищим (90% і до завершення вегетації рослини мали добре розвинену надземну і кореневу
систему).
Мікробна інфекція (дріжджові та інші гриби та бактерії) зазвичай з'являються на
поверхні середовища через кілька днів - до тижня часу у вигляді білого, сірого
або кольорового міцелію. Якщо при візуальному обстеженні виявлено мікробне
забруднення тоді всі посудини, що їх містять повинні бути знищені шляхом
прожарювання в автоклаві.
Стадія 2. Мультиплікація пагонів (розмноження культури). Після 4 - 6
тижнів після ініціації, в стабілізованих культурах тканин відбувається
проліферація пагонів (їх галуження). При утворенні певної кількості однакових
пагонів вони є придатними для пересаджування (субкультури). Кожен пагін, за
допомогою скальпеля і пінцета в стерильних умовах під витяжкою, відділяється
від загальної маси і розрізають на кілька живців або висаджують цілий на нове
середовище аналогічного складу як і попереднє. Звичайним на цій стадії
розмноження є висаджування значної кількості отриманих живців у контейнери (по
20 - 30 шт/один), оскільки культури пройшли фазу
ініціації і тепер ризик мікробного забруднення є значно нижчим. Великі
контейнери використовується у випадку
раціонального використання площі в лабораторії і для підвищення ефективності
вирощування продукції. Поділені на частини пагони поміщаються в такі ж
інкубаційні умови як і на першому етапі. Протягом наступних 4 - 6 тижнів
відбувається ріст їх вегетативної маси і проліферація (пагоноутворення).
Це означає, що розмноження і пересаджування культур можна проводити кожних 4 -
6 тижнів на регулярній основі.
При створенні оптимальних інкубаційних
умов та відповідного середовища, кожен вид рослин забезпечує прогнозовану
кількість пагонів протягом всього циклу розмноження. Їх кількість називається коефіцієнтом розмноження. Знання даного
показника необхідне для планування кількості
вихідних культур для отримання необхідної кількості пагонів, що будуть
переходити до наступної фази розмноження. Наприклад: для отримання 2000 пагонів
папороті, при умові щомісячного поділу культури (кожних 4 тижні) та коефіцієнті
розмноження - 5 - необхідно мати 500 рослин (культур). З них щомісяця будемо
отримувати 2500 пагонів, 500 з яких
будуть поміщатися в банк, а 2000 - на укорінення. Недоліком безперервного
серійного вироб-ництва є необхідність щомісячного
пересаджування і поділу культур навіть у періоди падіння попиту на рослини,
оскільки при ліквідації банку рослин відбувається істотне падіння рівня
виробництва і на його відновлення необхідний час і фінансові ресурси.
Стадія 3. Ризогенез (укорінення) культур. На цій стадії
необхідно створити умови для утворення на пагонах, що надходять із стадії
розмноження адвентивної кореневої системи. Існує два методи укорінення пагонів:
- метод А - укорінення в in vitro передбачає пересаджування відділених у фазі розмноження
пагонів на нове середовище, основним складником якого є один або суміш кількох
регуляторів росту - ауксинів, які вводяться до складу середовища. Цитокініни, які використовувалися в середовищах на
попередніх етапах розмноження у цій фазі не застосовуються - це означає, що у
рослинах проходить зміщення активності ростових процесів - вони перестають
галузитися (пригніується діяльність латеральних
меристем), більш активно розвивається верхівкова меристема: пагони збільшується
в рості і розпочинає утворюватися коренева система.
Висока концентрація агару (більше 1%)
робить середовище твердим, що негативно впливає на ріст коренів. Тривале
перебування пагонів деревних культур у середовищі з високим вмістом ауксину
негативно впливає на коренеутворення. Тому їх поміщають на середовище з ауксином лише на
1-3 дні, а далі пересаджують на нове середовище, що його не містить. Така
практика забезпечує добрі результати, проте додає ще одну стадію і вимагає
додаткових витрат на її проведення.
Для успішного перенесення рослин з
лабораторії у грунт вони не повинні мати дуже
розвиненої кореневої системи, достатньо того, що коренева система розпочала
утворюватися. При утворенні в лабораторії великих коренів на рослинах їх значно
складніше пересаджувати у тепличні контейнери і такі корені не завжди добре
функціонують в ґрунті або на іншому субстраті.
Тривалість перебування рослин на стадії коренеутворення - 2 - 4 тижні. При такій системі
укорінення, при початку утворення коренів на рослинах в контрольованих умовах in vitro вони пересаджуються в контейнери з грунтосумішшю
і поміщаються на дорощування і акліматизацію в теплиці (парники), а далі у
відкритий грунт.
- метод Б. Коренеутворення в лабораторних
(контрольованих) умовах in vitro у великих масштабах промислового
виробництва дуже дороге, тому існує
дешевший спосіб - коріння утворюється в умовах теплиці або парників,
тобто мікропагони висаджуються в стаканчики або палетні контейнери і переносяться в парники або теплиці, де
їм створюють умови, аналогічні як і при укорінення зелених живців. Такий спосіб має свої переваги: більша
швидкість висаджування неукорінених мікроживців ніж
вкорінених; вартість такого укорінення
значно нижча, ніж у лабораторії. Проте існує і ряд недоліків такого
способу укорінення.
Не вкорінені пагони з лабораторії не є
цілком сформованими і функціонуючими рослинами. Умови зовнішнього середовища
під час культивування тканин не забезпечували достатнього рівня фотосинтезу і рослини
були залежними від наявності вуглеводів у субстраті, крім того умови високої
вологості в умовах in vitro не сприяють утворенню достатнього
шару кутикули на листках і тому таким рослинам складно адаптуватися і вижити в
більш сухих умовах, а при збільшенні інтенсивності освітлення не вкорінені
рослини будуть відчувати водний стрес. Тому для успішного укорінення рослин в
умовах парника - теплиці слід створити умови високої вологості повітря і
субстрату, затінити від прямого сонячного світла і забезпечити помірно теплу температуру. Поганий контроль цих показників
у парнику є основною причиною загибелі рослин, оскільки вони не можуть
залишатися живими достатньо довго для того, щоб утворилася коренева система.
Окремою проблемою є ураження рослин грибковими хворобами, особливо в умовах
тепла і високої вологості, тому слід дотримуватися рекомендацій по стерилізації
субстрату і проводити захист рослин, застосовуючи хімічні засоби захисту.
Найкращими умовами для укорінення рослин
є теплиці з туманоутворюючими установками. В звичайних теплицях оправданим є
встановлення плівкових тунелей, в які поміщають
рослини на укорінення. Важливим є те, що в умовах високої вологості виникає
ризик перезволоження субстрату, тому для його приготування обирають компоненти
з високим показником пористості які будуть адсорбувати зайву вологу. Оскільки для прискорення укорінення
необхідний підвищений вміст ауксину у рослині, то в субстрат вводять
порошковидний або рідкий ауксин і замочують
в ньому нижню частину рослини. Робиться це під час висаджування живців.
Тривалість укорінення трав'янистих рослин, при забезпеченні оптимальних умов - 3 - 4 тижні; деревних
культур - дещо більше.
Стадія 4 - акліматизація і
дорощування рослин. Після укорінення in vitro рослини пересаджуються у 48 або 64 коміркові палетні
контейнери, які заповнюються пористим субстратом до складу якого дадається незначна частина органічних і мінеральних добрив,
а основна їх частина подається з поливом. При застосуванні з поливом
мінеральних добрив дотримуються рекомендацій і застосовують нижні дози,
оскільки дуже легко переудобрити субстрат в
контейнерах. Рослини витримують напівзатіненими до повної їх акліматизації і відновлення
ефективної фотосинтетичної діяльності.
Після успішного укорінення відбувається
збільшення інтенсивності росту і утворення нових листків - з цього часу можна
поступово збільшувати інтенсивність освітлення і знижувати температуру до
значень характерних для відкритого ґрунту. При доброму рості і розвитку рослин
їх переносять на відкриті площадки на дорощування,
реалізують або висаджують у шкілку. Всі зміни умов зовнішнього середовища
проводять поступово, оскільки різкі зміни можуть викликати тривалий стрес,
ушкодження рослин і навіть їх загибель.
Метод клонального мікророзмноження
рослин на штучних поживних середовищах в умовах in vitro в порівнянні із звичайним
(вегетативним) має переваги:
- дуже великий
коефіцієнт розмноження - у тисячі разів більший, ніж за звичайного
вегетативного розмноження (наприклад, з 1 рослини суниці садової можна одержати
в рік 1 млн. рослин і більше);
- рослини
звільняються від вірусів та іншої інфекції, тобто відбувається оздоровлення
посадкового матеріалу;
- дозволяє
розмножувати рослини цілорічно - поза залежністю сезону і погодних умов;
- можна
розмножувати важкорозмножувані рослини, наприклад, троянди, орхідеї;
- економляться
виробничі площі теплиць, які займають під маточні рослини;
- пробіркові
рослини можна легко транспортувати на будь-які відстані;
- меристеми
зберігаються протягом тривалого часу з допомогою кріометоду
(зберігання в умовах глибокого заморожування в рідкому азоті при температурі
-196оС), що дає можливість створювати банк їх цінних форм.
ХІД РОБОТИ
1. Наперед
підготувати (на першому лабораторному занятті) і простерилізувати в автоклаві
при тиску 1 атм. протягом 20 хвилин модифіковане
поживне середовище М-С для культивування апікальних меристем картоплі (дод.
табл.13).
2. У декількох
сортів картоплі проростити в темноті бульби (у термостаті при температурі 20-22оС.
На нестерильних паростках під мікроскопом (бінокулярною лупою) розглянути, як
виглядає апікальна меристема у картоплі. Детально відпрацювати технологію
вичленення апікальної меристеми.
3. Підготувати для
вичленення меристеми ламінар-бокс. Простерилі-зувати приміщення і ламінар
бактерицидними лампами.
4. Протерти
спиртом робоче місце - стіл, бінокулярну лупу, внутрішні стінки ламінара і штативи з пробірками.
5. Робочі
інструменти (пінцети, скальпелі, голки) стерилізувати перед кожним вичлененням,
занурюючи в спирт і обпалюючи на спиртівці.
6. З термостата
взяти пророщені бульби картоплі (різні сорти). Відрізати етильовані паростки,
опустити в хімічний стакан і залити 0,1%-м розчином діациду на 3-5 хилин
(або 1-6%-м розчином гіпохлорату
кальцію чи натрію, або 0,1%-м розчином сулеми).
7. Вийняти
паростки із стерилізуючого розчину і не менше 3 разів
промити їх стерильною водою.
8.
Простерилізовані паростки помістити в стерильну чашку Петрі і додати декілька
крапель стерильної автоклавованої води для
попередження підсихання паростків.
9. Помістити
паросток на предметний столик бінокулярного мікроскопа (лупи) і з допомогою
препарувальної голки під мікроскопом з верхівки паростка видалити покривні
листочки, послідовно оголюючи бокові і верхівкові меристеми з примордіальними листочками.
10. Звичайною
голкою, затиснутою в цанговий тримач, вичленити меристему, яка кусочок містить
шматочок рослинної тканини розміром 100-250 мікрометрів (0,1-
11. Вичленити
можна як верхівкову, так і бокові меристеми. Кожну операцію проводити окремим
простерилізованим інструментом.
12. Після
вичленення меристему на кінчику голки перенести на поверхню поживного
середовища у пробірку.
13. Обпалити
пробірку, обпалити корок над полум'ям спиртівки, закрити пробірку корком над
полум'ям спиртівки і поставити в штатив.
14. Штатив з
пробірками, в яких поміщені апікальні меристеми різних сортів картоплі, закрити
целофановим ковпаком для попередження підсихання середовищ і поставити у
світлову кімнату.
15. Через 2, 3, 4
тижні послідовно провести спостереження за розвитком рослин з меристем пагонів
і замалювати етапи цього процесу. Порівняти, як іде розвиток рослин з меристем
різних сортів картоплі; зробити відповідні висновки.
Робота захищена
балів.
Підпис викладача
Контрольні
запитання: Які бувають методи
культури тканин, охарактеризуйте кожного з них. В чому суть оздоровлення
рослин: методи оздоровлення та їх особливості? На чому грунтується метод мікроклонального розмноження? Типи (методи) мікрокло-нального
розмноження, їх суть та типи. Етапи мікроклонального розмноження та їх особ-ливості.
З яких завдань складається перший етап мікроклонального
розмноження рослин? Які основні фактори
впливають на ріст і розвиток рослинних експлантів,
охарактеризуйте їх? Стадія 2. Мультиплікація пагонів (розмноження
культури) її характеристика і особ-ливості
проходження. Які умови проходження Стадії 3 Ризогенез
(укорінення) культур їх характеристика і особливості проходження? Які існують
методи укорінення пагонів?
Стадія 4 - акліматизація і дорощування рослин, її характеристика і особливості проход-ження. Які переваги
методу клонального мікророзмноження
рослин на штучних поживних середовищах в умовах in vitro в порівнянні із звичайним
(вегетативним)?
Необхідно доповнити теоретичну
частину роботою 11 стор.
47