ТЕМА 5
МЕХАНІЗМ
ГОРІННЯ
5.1 .
Основи теорії ланцюгових реакцій
Багато специфічних
особливостей реакцій горіння і вибуху пояс– няются особливим – ланцюговим
механізмом цих процесів. У звичайних – неланцюгових реакціях – взаємодія
відбувається шляхом зіткнення між реагуючими молекулами. При зіткненні молекули
зсуваються до такої відстані , при якому електрони і атоми однієї молекули
потрапляють в сферу дії електричних сил іншої молекули . При зіткненні
відбуваються переходи електронів від одного атома до іншого і перегрупування
атомів , в результаті яких утворюються нові молекули. Щоб ці процеси відбулися,
потрібно мінімально необхідний запас енергії у молекул, що зіштовхуються.
Далеко не кожне зіткнення призводить до реакції. Зазвичай їх частка від загального
числа зіткнень становить величину від 10–15 до 10–20.
Зіткнення, що призводять до реакції, називаються активними зіткненнями, а молекули – активними молекулами.
У деяких реакціях, до
яких відносяться реакції горіння і вибуху, значну роль відіграють різні вільні
радикали (осколки молекул) і атомів з ненасиченою валентністю, які утворюються
з тих чи інших причин. Такі утворення, що називаються проміжними активними частинками, мають неспарені електрони і
володіють дуже високою реакційною здатністю. Вони прагнуть будь–яким способом
приєднати до себе інші атоми або активні частинки, щоб реалізувати свої
валентні можливості. Часто їх реакції зі звичайними молекулами мають дуже
низьку енергію активації, тому частка ефективних зіткнень дуже висока (близька
до 1). Тому при перших же зіткненнях з іншими молекулами вони викликають
протікання хімічних реакцій між собою. Час життя таких молекул дуже малий. Якщо
врахувати, що в газі при тиску 1 атм. кожна молекула зазнає близько 1 * 1010
зіткнень, то час життя активних частинок складає ~ 10–10 с. Нижче ви познайомитеся з механізмами деяких
ланцюгових реакцій горіння, в яких реакції активних частинок мають досить
високу енергію активації (десятки кДж / моль). Для них частка ефективних
зіткнень на кілька порядків менше 1 і далеко не кожне зіткнення закінчується
результативно. Наприклад, при температурі 300К частка ефективних зіткнень для
реакцій з енергією активації 5, 10, 15, 20 і 50 кДж/моль приблизно дорівнює
відповідно 10–1 , 10–2 , 10–3 , 10–4
і 10–9.
Особливість взаємодії
вільних радикалів або атомів полягає у тому, що при їх взаємодії з звичайними
молекулами завжди утворюються нові активні частинки. Активні частинки не можуть
зникнути шляхом зіткнення і взаємодії з насиченими частинками. Тому поки існує
вільний радикал або атом, відбувається безперервний процес створення нових
активних частинок. Зникнути активні частинки можуть або шляхом зіткнення з
іншою активною часткою або зі стінкою посудини.
Ланцюговими називаються реакції, в яких поява однієї активної частинки
викликає велике число перетворень неактивних частинок внаслідок регенерації
активної частинки у кожному елементарному акті реакції.
У створенні теорії
ланцюгових реакцій основну роль відіграв радянський вчений академік М.М
Семенов. Він показав, що ланцюгові реакції є досить поширеними і відіграють
важливу роль у багатьох практично важливих процесах органічної хімії,
наприклад, при горінні палива, при крекінгу,
полімеризації, бромуванні, хлоруванні, реакціях терморозпаду та ін.
5.2.
Механізм горіння водню в кисні
Стехіометричне
рівняння реакції записується у вигляді:
2Н2 +
О2 = 2Н2О.
Пряма взаємодія
молекул водню і кисню не відбувається, і механізм процесу
носить ланцюгової характер.
Реакція зародження ланцюга.
Можливі три варіанти
реакції зародження ланцюга:
Розкладання молекул
водню при зіткненні зі збудженої молекулою:
Н2 + М * = Н ∙ +
∙ Н + М (12)
Зіткнення збуджених
молекул водню і кисню:
Н2 * + О2 *
=
2 ∙ОН (13)
У газоподібній
суміші, як правило, містяться пари води:
М * + Н2О = Н∙ +
∙ОН +
М (14)
Низька енергія
зв’язку
Н–O
в молекулах Н2О в порівнянні з енергіями зв’язку Н–Н і О=О в молекулах Н2 і
О2 робить
реакцію (14) основною реакцією зародження ланцюга.
Продовження ланцюга
× (15)
∙ (16)
Розгалуження ланцюга ×О∙
+ Н2 ® ×ОН.+
×Н (17)
Обрив ланцюга НО×
+ ×Н ® Н2О (18)
Якщо скласти реакції
(15) – (18) отримаємо брутто–реакцію:
2Н2 +
О2 = 2Н2О.
У реакції (16 )
утворюється частинка з двома неспареними електронами –
бірадикал.
У цій реакції одна активна частка утворює дві нових, тому реакція ( 16 ) є
реакцією розгалуження ланцюга.
Реакції (15–17) мають
різні енергії активації – відповідно 22, 71 і
41 кДж/моль. Так як найбільший енергетичний бар’єр має реакція (16), то вона
найбільш повільна і є лімітуючою.
Завдяки розгалуженню
відбувається потроєння числа активних частинок після кожної пари
реакцій (16) і (17) . Число активних частинок збільшується хвилеподібно
. Після n пар реакцій (16) і (17) розгалуження їх числа
стає рівним 3n. Наприклад, всього лише після 50 пар реакцій
розгалуження число активних частинок стає рівним ~ 1*1024 . Це
величезне число. Кожна нова активна частинка починає новий
ланцюг. Після кожної пари реакцій (16) і (17) один ланцюг розгалужується на
три. Тому правильніше було б говорити про збільшення кількості ланцюгів в
результаті розгалуження , тобто про хвилеподібне
прискорення
реакції горіння.
За такою ж схемою розвивається ядерний вибух – один утворений нейтрон
поглинається ядром урану і викликає його розпад з утворенням двох нейтронів, і
т.д. Через мить число нейтронів досягає колосальних величин, і відбувається
вибух.
НО
Схематично ланцюгова реакція горіння водню представлена на рис. 4.
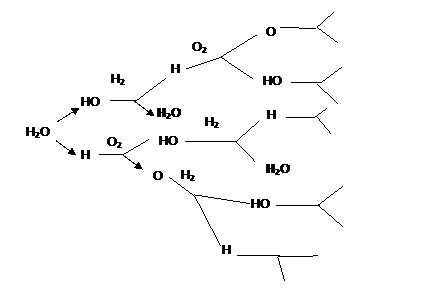
Рис. 5.1.
Механізм
горіння водню в кисні.
5.3. Межі
займання. Півострів займання.
Для розгалужених ланцюгових реакцій існує залежність здатності гомогенної
суміші до займання від температури і тиску суміші. Ця залежність
називається півостровом займання. Типовий графік залежності виглядає так:
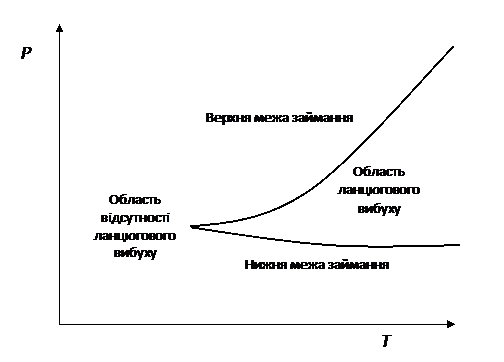
Рис. 5.2. Півострів
займання водню в кисні.
Верхня і нижня
крива утворюють верхню і нижню межі займання. За умов вище верхньої межі або
нижче нижньої межі займання неможливо. Пояснення існування меж займання
пов’язано з співвідношенням швидкості розгалуження і швидкості
обриву ланцюга. Якщо перша більша другої,
то займання станеться. В іншому випадку при постійно діючому джерелі
запалювання реакція переходить в стаціонарний режим.
Існування нижньої межі пов’язане з тим, що при зниженні тиску
швидкість реакції розгалуження зменшується, так як вона пропорційна
концентрації речовин. Водночас швидкість обриву ланцюга на стінках збільшується
через зниження концентрації молекул і числа зіткнень, що перешкоджають
досягненню стінок активними частинками. Збільшується довжина вільного пробігу
активних частинок. Все більша частка активних частинок може досягти стінок
посудини. При деякому тиску швидкість обриву ланцюгів на стінці виявиться більшою
швидкості розгалуження ланцюгів, і реакція перейде в стаціонарний режим.
Існування верхньої межі пов’язано з тим, що з ростом тиску
швидкість обриву ланцюга в обсязі, яка пропорційна квадрату тиску (див. реакцію
21, в
якій беруть участь 2 звичайних молекули), починає переважати над швидкістю
розгалуження, яка пропорційна першому ступеню
тиску. Реакція в умовах вищих верхньої межі також
переходить в стаціонарний режим, при якому швидкість зазвичай дуже мала.
Конкретні значення
величин тиску і температури відрізняються для різних систем. Наприклад, точка,
в якій з’єднуються верхня і нижня крива (мис півострова займання ), для суміші
водню і кисню, відповідає тиску
Верхня межа значно
залежить від температури. На нього чинить також сильний вплив
природа і кількість домішок, що віграють роль третьої
частинки при обриві. На нього мало впливає форма і розмір посудини. Навпаки,
на нижню межу впливає форма посудини, її діаметр і матеріал його
стінок. Вплив температури на нижню межу незначний. Тому
кожному складом суміші і кожній реакційній
посудині
відповідає своя область займання. При постійному загальному тиску пального і
окислювача зміна їх співвідношення також призводить до зміни меж займання. При
зниженні концентрації пального (при збереженні постійним загального тиску) весь
графік зміщується вправо паралельно осі температури. При додаванні в горючу
суміш інертного газу межі займання також будуть змінюватися. Наприклад , нижня
межа буде знижуватися. Суміш, яка могла перебувати поза межами
займання, при додаванні інертного газу може потрапити всередину півострова і
спалахнути.
5.4. Механізм
горіння оксиду вуглецю ( II)
Оксид вуглецю СО є одним з найважливіших і таким, що широко застосовується
в промисловості видів газоподібного палива. Він застосовується в металургії, де
виходить при коксуванні вугілля. Він є основним компонентом горючої газової
суміші при газифікації вугілля (перетворенні
вугілля в газоподібне паливо).
Особливістю реакції є те, що вона йде дуже повільно, якщо в суміші відсутні
пари води. Константа швидкості горіння сухого і вологого СО відрізняється на
шість порядків. Пояснюється це тим , що молекула СО має дуже міцний хімічний
зв’язок, і не розпадається при звичайних умовах запалювання. Вище повідомлялося
, що молекула кисню також дуже міцна і не може служити джерелом радикалів. Тому
процес різко прискорюється в присутності парів води.
Зародження ланцюга.
М * + Н2О = ОН∙ + ∙Н
( 24 )
Продовження ланцюга.
Н∙ + О2 = ОН∙+ О: (
25 )
ОН∙+ СО = СО2 + Н∙
( 26 )
Реакція (26) є основною реакцією утворення кінцевого продукту горіння
оксиду вуглецю СО2.
На перший погляд, реакція ( 25 ) є реакцією розгалуження ланцюга. Однак
особливість механізму горіння СО полягає в тому, що бірадікал кисню вловлюється
оксидом вуглецю і далі не дає ніяких активних частинок :
О: + СО = СО2 (
27 )
Тому реакція горіння, незважаючи на наявність стадії розгалуження ланцюга,
не вважається розгалуженою ланцюговою реакцією.
Обрив ланцюга.
Реакції обриву ланцюга ідентичні описаним для горіння водню. До них
відносяться реакції обриву в об’ємі радикалів водню, кисню і ОН .
Обрив на стінці проходить за реакціями (21) – (23).
Експериментально отримана залежність швидкості горіння СО виглядає
наступним чином:
![]() ( 28 )
( 28 )
Важлива роль води для реакції горіння СО підтверджується тим, що її
концентрація входить в кінетичне рівняння реакції.
Енергія активації реакції дорівнює 28,3 кДж / моль.
5.5. Механізм
горіння метану
Метан є найпростішим насиченим вуглеводнем і найважливішим газоподібним
паливом. Брутто-процес записується простою реакцією :
СН4 + 2О2 = СО2 + 2Н2О ( 29 )
Однак механізм цієї реакції дуже складний. У реакції зародження ланцюга
важливу роль відіграють пари води. При їх відсутності радикали утворюються при
розпаді молекули метану, а в присутності води – при більш швидкій реакції
розкладання молекул води.
Зародження ланцюга.
СН4 + М * = ∙ СН3 + Н∙ + М (
30 )
М * + Н2О = ОН ∙ + Н∙ ( 31 )
Продовження ланцюга.
Н∙ + О2 =ОН∙ + О: (
32 )
Ця реакція є реакцією розгалуження ланцюга.
Далі молекули СН4 беруть участь у двох паралельних реакціях,
утворюючи метильний радикал:
СН4 + ОН∙= ∙СН3 + Н2О ( 33 )
СН4 + О: = ∙СН3 + ОН ∙
( 34 )
У свою чергу, метильний радикал також бере участь у двох реакціях:
∙СН3 + ОН∙ = :СН2 + Н2О ( 35 )
∙ СН3 + О2 = Н2СО + ОН∙ ( 36 )
У першій з цих реакцій утворюється метиленовий бірадікал ( карбен ), а в
другій – формальдегід.
Формальдегід є одним з продуктів реакцій розгалуження метану та інших
вуглеводнів. Тому він присутній в автомобільних викидах і призводить до
забруднення навколишнього середовища.
Формальдегід утворюється і з карбену:
:СН2 + О2 = Н2СО + О: (
37 )
Формальдегід приймає участь у двох реакціях продовження ланцюга
Н2СО + О : = СО + Н2О
( 38 )
Н2СО + ОН∙ = НСО∙ + Н2О ( 39 )
а радикал
НСО∙ дає ще одну реакцію розгалуження:
НСО∙ + О2 = СО + О: + ОН∙ ( 40 )
Оксид вуглецю реагуєза двома паралельними реакціями з утворенням кінцевого
продукту окислення вуглецю :
О: + СО = СО2
( 41 )
ОН∙ + СО = СО2 + Н∙
( 42 )
Таким чином, в процесі протікання реакцій продовження ланцюга відбувається
послідовна втрата вуглецем атомів водню і перетворення метану за ланцюжком: СН4 → ∙СН3 → :СН2
→ НСО∙ → СО → СО2.
Обрив ланцюга.
Реакції обриву
аналогічні тим , що були розглянуті раніше для горіння водню і СО.
Неважко уявити, наскільки ускладнюється механізм горіння ще складніших
вуглеводнів, ніж метан. А для бензинів, які складаються з сотень насичених,
ненасичених і ароматичних вуглеводнів, знання механізму горіння є просто
нереальним завданням.
5.6. Механізм
горіння вуглецю
Вуглець є найважливішим твердим видом палива, широко застосовуваним в
котельнях, промислових теплогенеруючих установках і на теплоелектростанціях.
Його горіння є гетерогенним процесом і має свої особливості. Брутто–процес дуже
простий:
С + О2 → СО2 (
43 )
Однак механізм горіння більш складний. Залежно від стадії горіння
розрізняють два механізми.
На початковій стадії, коли відбувається разгоряння речовини і температура
невисока (до 1000 °С), механізм наступний:
Зародження ланцюга.
У реакції зародження ланцюга, як уже було в механізмі горіння водню і СО,
бере участь вода:
М * + Н2О = ОН∙ + Н∙ ( 44 )
Продовження ланцюга.
Н∙ + О2 = ОН∙+ О:
( 45 )
Ця реакція також нам знайома за механізмами горіння водню і СО.
Далі активні частинки реагують на поверхні з вуглецем. Вуглець являє собою
природний полімер (позначимо його Сх), в якому кожен атом С
з’єднаний чотирма хімічними зв’язками з іншими атомами С. При взаємодії з
активною часткою два з цих хімічних зв’язків руйнуються і до атома вуглецю
приєднується атом кисню. Утворюється т.зв. вуглецево – кисневий комплекс –
частково окислений полімер вуглецю :
Сх + ОН∙ = Сх– 1CО+ Н∙ ( 46 )
Цей комплекс може або руйнуватися при температурі горіння, або реагувати з бірадикали
кисню :
С х– 1СО = Сх– 1 + СО ↑ ( 47 )
2Сх–1СО + О: = 2Сх – 1
+ СО ↑ + СО2 ↑ ( 48 )
Вуглець може реагувати і з бірадікали кисню :
Сх + О: = Сх–1СО
( 49 )
Утворення бірадикалу кисню, як і в реакції горіння СО, не є реакцією
розгалуження ланцюга, так як він надалі поглинається і не дає нових радикалів.
Одночасно з розібраним механізмом на нього накладається механізм горіння СО
, який ми вивчали вище.
Обрив ланцюга аналогічний розглянутому для реакцій горіння СО і водню.
При підвищенні температури в процесі горіння вуглець може окислюватися не
тільки киснем, але і за допомогою СО2:
Сх + СО2 = Сх–1СО + СО ↑ (
50 )
Чим вища температура, тим ефективнішим стає цей спосіб окислення вуглецю.
При температурах близько 1500 °С і вище вуглець практично повністю окислюється
за допомогою СО2. На цій стадії механізм виглядає наступним чином.
Вуглець окислюється за реакцією( 50). Всі розглянуті вище процеси продовження
ланцюга не відіграють суттєвої ролі . У газовій фазі на поверхні вуглецю
відбувається горіння СО за вивченим вище механізмом . Цей процес повністю
використовує кисень, що дифундує в полум’я, який не доходить до
поверхні вуглецю. Таким чином, кисень безпосередньо взагалі не бере участі в
реакції окислення вуглецю.
Такий механізм носить назву подвійного
палаючого шару, де перший з них – шар палаючого а атмосфері СО2
вуглецю , а другий – горючий в атмосфері кисню СО.
Швидкість горіння вуглецю в основному визначається площею поверхні. Для
інтенсифікації процесу в промислових установках вугілля перед використанням
подрібнюється до пилоподібного стану і вприскують в сопло у вигляді аерозолю.
Процес горіння такого вугілля добре регулюється.
У домашніх котельнях вугілля зазвичай використовується у вигляді досить
великих шматків.
Контрольні запитання:
1.
Якi характернi стадiї ланцюгових хiмiчних реакцiй?
2.
В чому полягає особливість
горіння водню в кисні?
3.
Що таке півострів займання?
З чим пов’язане існування верхньої та нижньої межі займання?
4.
Як протікає горіння оксиду
карбону (ІІ)?
5.
В чому полягає механізм
горіння метану?
6.
Поясніть механізм
горіння вуглецю Чим визначається швидкість цього процесу?

