Практична робота №5
Тема: Визначення температури горіння,
концентрації та тиску насиченої пари речовин.
Мета: ознайомити
студентів з порядком визначення показників та ступеню пожежної небезпеки.
5.1.Поняття температури
горіння
Горючі речовини мають різну теплотворну
здатність, тому температура на пожежах залежить не лише від кількості речовини,
що горить, але й від її складу.
Максимальна температура, до
якої нагріваються продукти згоряння, називається температурою горіння. Температуру горіння визначають за формулою:
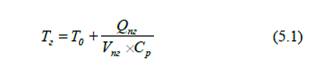
де Тг – температура
горіння, К;
Т0
– початкова температура горючої речовини або окисника, К;
Qпг
– кількість тепла, що витрачається на нагрівання продуктів
згоряння, кДж/кг;
Vпг
– об’єм продуктів згоряння, м3/кг;
Ср
– питома теплоємність продуктів горіння, кДж/(м3×К).
Розрізняють калориметричну, адіабатичну, теоретичну та дійсну температуру горіння.
Калориметрична температура
горіння – це температура, до якої нагріваються
продукти повного згоряння при найсприятливіших умовах:
-
все тепло, що виділяється
при горінні, витрачається на нагрівання продуктів згоряння (втрати тепла на
нагрівання конструкцій та випромінювання в навколишнє середовище рівні нулю) Qпг = Qн
;
– початкова
температура горючої суміші Т0 = 273 К, а
початковий тиск
Р0 = 101,3 кПа;
–
відбувається повне згоряння горючої суміші;
–
кількість повітря, що надходить до зони горіння, дорівнює теоретично необхідній
α = 1.
Адіабатична
температура горіння – це така температура, коли виконуються наступні умови,
дещо відмінні від калориметричної:
–
тепловтрати у навколишнє середовище відсутні (Qпг =Qн);
–
початкова температура і тиск горючої суміші становлять відповідно Т0 = 273 К, а Р0 =
101,3 кПа;
–
горіння проходить з надлишком або нестачею повітря тобто α≠1.
Теоретична температура
горіння
трохи нижча за калориметричну, враховує ендотермічні процеси дисоціації
продуктів згоряння при високих температурах і характеризує горіння, що
проходить за умов:
–
частина тепла витрачається на дисоціацію (розклад молекул на прості молекули, атомні групи або іони) продуктів
згоряння (Qпг =Qн-
Qдис);
–
початкова температура горючої суміші
Т0 = 273 К, а початковий тиск Р0 = 101,3 кПа;
–
кількість повітря, що надходить до зони горіння, дорівнює теоретично необхідній α = 1.
Дійсною вважають
температуру горіння, до якої нагріваються продукти горіння в реальних умовах
пожежі:
– частина тепла втрачається
через недопал та на нагрівання навколишнього середовища (Qпг =Qн- Qнед-Qвт);
– горіння
проходить з надлишком або нестачею повітря (α ≠1);
– початкова температура
горючої суміші Т0≠
273 К, а початковий тиск Р0≠ 101,3 кПа,
де Qдис –
кількість тепла, що витрачається на дисоціацію продуктів горіння;
Qнед – кількість тепла, що
втрачається через недопал горючої речовини;
Qвт –
кількість тепла, що втрачається у навколишнє середовище.
Визначити температуру
горіння експериментальним шляхом досить складно, так як це пов’язано з
необхідністю проведення експерименту в умовах високих температур, підвищеної
токсичності, різної реакційної здатності речовин, що горять та нестабільністю
газового середовища. Дійсна температура у різних точках пожежі різна.
Найбільшою вона може бути у зоні горіння або полум’я, а з висотою полум’я може
мінятися в ту чи іншу сторону, залежно від природи та вмісту речовин, що горять.
5.2.Визначення
адіабатичної температури горіння
Як правило, адіабатичну
температуру горіння речовин визначають за допомогою методу лінійної
інтерполяції:
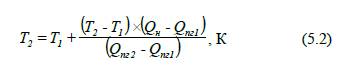
де T1,
T2 – температура горіння у першому та другому наближенні
відповідно, К;
Qн – нижча теплота згоряння речовини, кДж/моль;
Qпг1, Qпг2– тепловміст продуктів згоряння при температурі
T1 і T2
відповідно, кДж/моль.
Як
було зазначено вище, продукти згоряння у переважній більшості складаються з
азоту, який участі у горінні практично не приймає. Тому температуру горіння у
першому наближенні Т1, визначають за
значенням середньої ентальпії (тепловмісту) продуктів згоряння (ΔНср),
орієнтуючись
на ентальпію азоту. Оскільки тепловміст карбон діоксиду і парів води є вищими,
ніж азоту, то їх присутність у продуктах згоряння знижує температуру горіння,
тому як результат – її слід приймати дещо нижчою, ніж за азотом.
Середню ентальпію продуктів
згоряння визначають за формулою:
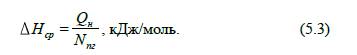
Для визначення температури
горіння у другому наближенні T2 необхідно
порівняти значення тепловмісту продуктів горіння при температурі T1
зі значенням нижньої теплоти згоряння:
ü якщо Qпг1< Qн, то Т2> Т1;
ü якщо Qпг1> Qн, то Т2< Т1.
Тепловміст продуктів горіння
при температурі T1та T2
визначають за формулою:
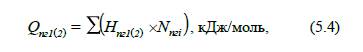
де H пгі1( 2 ) – ентальпія і-го компонента продуктів згоряння при температурі
T1
та T2
відповідно, кДж/моль;
Hпгі – кількість молів і-го компонента продуктів згоряння, моль/моль.
Приклад 5.1:
Визначити адіабатичну температуру горіння
бутанолу (С4Н10О), якщо
його стандартна теплота утворення становить – 274,6 кДж/моль, а горіння
проходить з надлишком повітря 1,2.
Вирішення:
1.
Складаємо рівняння реакції
горіння бутанолу:
С4Н10О + 6(О2 +3,76
N2)= 4СО2 +5Н2О +6×3,76 N2.
2.
Визначаємо питоме число
молів повітря та продуктів згоряння бутанолу:
Nпов0 = 4,76×β
= 4,76×6 = 28,56 моль/моль;
N пг0
= 4 + 5 + 6×3,76 = 31,56моль/моль.
3.
Визначаємо дійсне питоме
число молів продуктів горіння:
![]()
4. Використовуючи
закон Гесса, визначаємо нижчу молярну теплоту згоряння бутанолу:
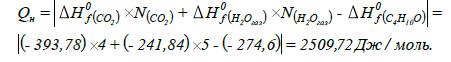
5. Визначаємо
середню ентальпію (тепловміст) продуктів згоряння бутанолу:
![]()
6. ![]() Взявши
за орієнтир ентальпію азоту, визначаємо
температуру горіння Т1 у першому наближенні: Т1
= 2000 К
Взявши
за орієнтир ентальпію азоту, визначаємо
температуру горіння Т1 у першому наближенні: Т1
= 2000 К
7. Визначаємо
тепловміст продуктів горіння Qпг1
при температурі горіння Т1:
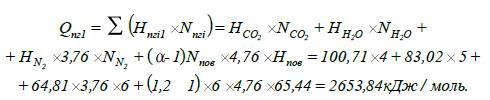
8. Визначаємо
температуру горіння Т2 у другому
наближенні. Враховуючи, що тепловміст продуктів згоряння бутанолу при
температурі Т1![]() виявився
більшим за нижчу теплоту згоряння речовини, то температура Т2 має
бути меншою за Т1. Враховуючи це, приймаємо:
виявився
більшим за нижчу теплоту згоряння речовини, то температура Т2 має
бути меншою за Т1. Враховуючи це, приймаємо:
Т2 = 1800 К
9. Визначаємо
тепловміст продуктів горіння Qпг2
при температурі Т2:
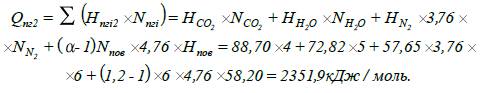
10. Визначаємо
адіабатичну температуру горіння бутанолу методом лінійної інтерполяції:
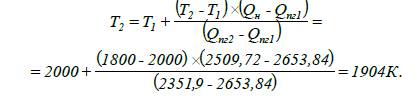
Відповідь:
адіабатична температура горіння бутанолу при заданих умовах становить 1904 К.
5.3. Пожежовибухонебезпека
речовин та матеріалів
Пожежна
небезпечність речовини (матеріалу) – сукупність
показників, що кількісно характеризують властивості речовини (матеріалу), які
можуть бути чинниками пожежної небезпеки об’єкта і характеризують їх здатність
до виникнення і поширення горіння.
Речовини і матеріали,
властивості яких будь-яким чином сприяють виникненню або розвитку пожежі,
відносять до пожежонебезпечних. До
них відносяться речовини різних класів: горючі, важкогорючі та негорючі,
речовини-окисники тощо.
Показники
пожежовибухонебезпеки речовин і матеріалів визначають з метою отримання
вихідних даних для розробки та створення системи забезпечення
пожежовибухобезпеки. Вони використовуються для аналізу пожежної небезпеки, для
класифікації небезпечних вантажів; для вибору категорії приміщень, будівель та
зовнішніх установок згідно з вимогами норм технологічного проектування,
стандартів ССБП, будівельних норм і правил, правил будови електроустановок, а
також з метою здійснення технічного нагляду за виготовленням матеріалів і
виробів та їх наступного використання. Правильна оцінка пожежної небезпечності
матеріалів, технологічних процесів, об’єктів загалом має велике значення,
оскільки визначає заходи запобігання виникнення та розвитку пожежі. Обґрунтована
оцінка пожежної небезпеки виробництва чи об’єкту, прийняття відповідних
запобіжних заходів має велике соціальне значення і забезпечує безпечні умови
праці, а значить – здоров’я і життя людей.
Пожежовибухонебезпечність
речовин і матеріалів, особливості горіння визначається показниками, вибір яких
залежить від природи речовини, а саме від її фізико-хімічних властивостей та
умов їх застосування чи використання. Перш за все, необхідно з’ясувати до якого
класу належить речовина, які має властивості і у якому агрегатному стані
перебуває.
Ступінь пожежної
небезпечності горючих рідин залежить від групи горючості, температур спалаху,
спалахування, самоспалахування, концентраційних та температурних меж поширення
полум’я, тиску вибуху тощо.
Особлива
пожежонебезпечність горючих газів та парів ЛЗР зумовлена їх здатністю
утворювати з повітрям вибухонебезпечні суміші. Вибухонебезпечними вважаються
суміші з повітрям горючих газів і парів ЛЗР, що мають температуру спалаху 45°С
та нижче, а також суміші горючих пилу та волокон з повітрям, які мають нижню
межу спалахування не вище 65 г/м3.
Пожежо-
та вибухонебезпечні властивості пилу оцінюють, головним чином, за температурою
його самоспалахування і та нижніми концентраційними межами поширення полум’я
(НКМПП).
Вибухонебезпечність пилу
багато в чому залежить від його дисперсності. Чим вища дисперсність пилу, тим
більша його поверхня контакту з повітрям і тим вища небезпека вибуху.
Характеристиками пожежної
небезпечності твердих горючих речовин і матеріалів є група горючості, температури
спалахування та самоспалахування. За горючістю ці речовини поділяються на
горючі та важкогорючі.
Горіння складних за хімічним
складом твердих горючих речовин може протікати по-різному. Речовини, що здатні
при нагріванні плавитися (пластмаси, каучук, жири та ін.), горять з утворенням
розріджених смол і доволі часто утворюють токсичні продукти горіння: карбон
оксид, гідроген хлорид, амоніак, ціанідну кислоту, фосген та ін. Речовини, що
здатні при нагріванні розкладатися, перетворюються на пари та гази (деревина,
бавовна, целулоїд та ін.), які згоряють. Таким чином, складні речовини самі не
горять, а горять продукти їх розкладу.
5.4.
Визначення тиску насиченої пари
5.4.1. Визначення тиску насиченої пари за константами
Антуана
Для
розрахункового визначення тиску насиченої пари рідини або їх сумішей
використовують наступні формули:
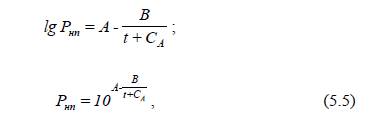
де
t – температура рідини, ºС;
А, В, СА
– константи
Антуана, що визначаються для кожної рідини з додаткових джерел.
Приклад 5.2:
Визначити тиск насиченої
пари та фактичну концентрацію насиченої пари оцтової кислоти (С2Н4О2) при
температурі 20 ºС та тискові 101 кПа.
Вирішення:
1.
За додатковими джерелами визначаємо
константи Антуана для оцтової кислоти:
А = 7,1033; В = 1906,53; СА = 255,97.
2.
Визначаємо тиск насиченої
пари при заданій температурі:
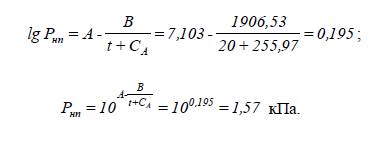
3. Визначаємо
фактичну концентрацію насиченої пари оцтової кислоти:
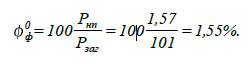
Відповідь:
за даних умов тиск насиченої пари оцтової кислоти становитиме 1,57 кПа, а
концентрація – 1,55 %.
5.4.2. Визначення
тиску насиченої пари методом лінійної інтерполяції
Для багатьох поширених
горючих рідин тиск насиченої пари визначений при деяких фіксованих значеннях
температури і зведений до довідників у вигляді таблиць. Тиск насиченої пари
таких речовин при будь-якій температурі можна визначити за методом лінійної
інтерполяції. Для цього необхідно знайти два значення температури, що є
найближчим значенням до заданої температури (t1<tф<t2)
і
значення тиску насиченої пари ( Pнп1 і
Pнп2 ) при
цих температурах.
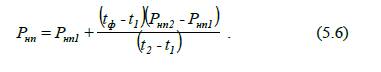
Приклад 5.3:
Визначити тиск насиченої пари,
концентрацію пари та ступінь пожежовибухонебезпечності кумолу (С9Н12) при температурі 15
ºС та тискові 102 кПа, якщо концентраційні межі поширення полум’я для
кумолу становлять 0,88-6,1 %.
Вирішення:
1.
За додатковими джерелами визначаємо
два значення температури t1 і t2, що є найближчими до
заданої температури tф та значення тиску насиченої пари при цих
температурах:
t1
= 2,8 ºС <tф = 15 ºС <t2 = 38,3 ºС
Pнп1= 0,133 кПа
Pнп2 = 1,333 кПа
2.
Визначаємо тиск насиченої
пари кумолу при заданій температурі:
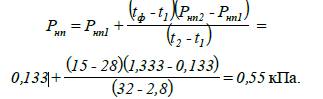
3.
Визначаємо фактичну
концентрацію насиченої пари при заданих умовах:
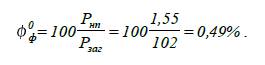
4.
Визначаємо ступінь
пожежовибухонебезпечності насиченої пари кумолу:
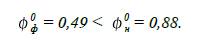
Відповідь:
при заданих умовах насичена пара кумолу не утворюватиме вибухонебезпечну
концентрацію.

