Практична робота №4
Тема: Розрахунок енергетичного балансу горіння
речовин.
Мета: ознайомити
студентів з порядком визначення
енергетичного балансу горіння речовин.
4.1. Поняття
енергетичного балансу процесів горіння
Хімічні
реакції можуть проходити як з поглинанням так і з виділенням енергії. Реакції,
що протікають з поглинанням енергії, називаються ендотермічними (ендо –
всередину). Реакції, що протікають з виділенням енергії є реакції горіння і
називають екзотермічними (екзо – назовні). Кількість тепла, що
виділяється в результаті хімічної реакції горіння, називають тепловим ефектом реакції горіння.
Енергія
буде виділятись у тому випадку, якщо на розриви старих зв’язків між молекулами
її витрачається менше, ніж на створення нових, тобто у горючій системі є
надлишок енергії. Саме такі реакції спричиняють горіння і, як наслідок –
пожежу.
При
горінні енергія виділяється у вигляді світіння та тепла. Через те, що світлова
енергія згоряння незначна, її, як правило, ототожнюють з тепловою.
4.2. Теплота згоряння та
порядок її визначення
Теплотою згоряння називається
кількість тепла, що виділяється при згорянні одиниці маси речовини з утворенням
продуктів повного згорання.
Залежно
від способу вираження маси речовини розрізняють стандартну Q кДж/моль (молярну), масову Q
кДж/кг та об’ємну Q° кДж/м3 теплоту згоряння речовини.
У
розрахунках визначають масову та й об’ємну теплоту згоряння речовин та
матеріалів.
Залежно
від виділення теплоти і утворення рідкої і газоподібної води, розрізняють вищу
та нижчу теплоти згорання речовини.
Вища теплота згоряння
Qв визначається при умові, якщо в результаті
реакції горіння волога, що міститься в речовині, виділяється з утворенням води
у стані рідини, тобто прихована теплота пароутворення була відведена.
Нижча теплота
згоряння Qн визначається при умові, якщо в результаті
реакції горіння волога, що міститься в речовині, виділяється у газоподібному
стані, тобто водень згоряє з утворенням води, яка знаходиться у продуктах
згоряння у вигляді пари.
Теплота
згоряння тісно пов’язана з таким поняттям як теплота утворення ΔН0, що
виділяється при утворенні одного моля сполук горючих речовин.
Для визначення стандартної
(молярної) теплоти згоряння (при стандартних умовах) визначають теплоту
утворення продуктів горіння і горючої речовини розрахунком.
Відповідно до першого закону
термохімії, певна кількість тепла, яка виділяється (або поглинається) при
утворенні будь-якої сполуки, при тих же умовах поглинається (або виділяється)
при розпаданні цієї ж сполуки.
Відповідно до закону Гесса (другий закон термохімії),
тепловий ефект реакції визначається як різниця теплоти утворення кінцевих та
початкових компонентів системи, і не залежить від проміжних стадій та шляху,
яким проходить вказаний процес.
Враховуючи, що теплота
утворення простих речовин (оксигену і нітрогену) рівна нулю, теплоту реакції
горіння можна представити у вигляді:
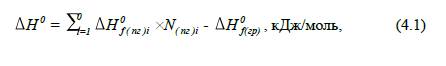
де Δ H 0f (пг)і – стандартна теплота утворення і-го компоненту продуктів горіння,
кДж/моль;
N(пг)і –
кількість
молів і-го компоненту продуктів
горіння;
Δ H0f (гр) – стандартна теплота
утворення горючої речовини у газоподібному стані, кДж/моль.
Оскільки, нас цікавлять лише
реакції горіння, які протікають з виділенням тепла, то знак «–» можна опустити
і тоді формула для визначення теплоти згоряння матиме вигляд:
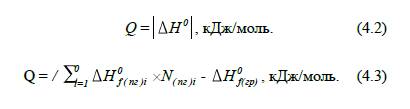
4.3. Визначення
теплоти згоряння індивідуальних хімічних речовин
Масову та об’ємну теплоту
згоряння індивідуальних хімічних речовин можна визначити через молярну теплоту
згоряння, використовуючи формули:
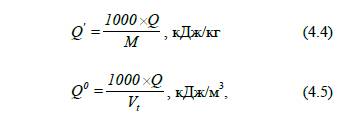
де
Q – молярна
теплота згоряння горючої речовини, кДж/моль;
М – молярна маса, г/моль; Vt – молярний
об’єм газу, м3/моль.
Приклад 4.1:
Визначити нижчу та вищу
молярну, масову та об’ємну теплоту згоряння гексану (С6Н14)
при
стандартних умовах.
Вирішення:
1.
Складаємо рівняння реакції
горіння гексану:
С6Н14 + 6,5(О2 +3,76
N2) = 6СО2 +7 Н2О +6,5×3,76 N2.
2.
За допоміжними даними визначаємо
стандартні теплоти утворення гексану, карбон (ІV) діоксиду та води:
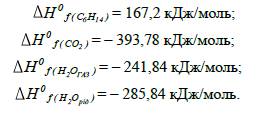
3.
Визначаємо молярну теплоту
згоряння гексану, використовуючи закон Гесса та враховуючи при розрахунку
нижчої теплоти згоряння стандартну теплоту утворення води у вигляді пари
(газу), а при розрахунку вищої теплоти згоряння – у вигляді рідини:
![]()
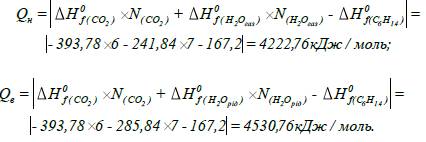
4.
Визначаємо молярну масу
гексану:
М(С6Н14) = 12×6 + 1×14 = 86 г/моль
5.
Визначаємо масову теплоту
згоряння гексану:
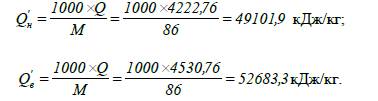
6. Визначаємо об’ємну
теплоту згоряння гексану:
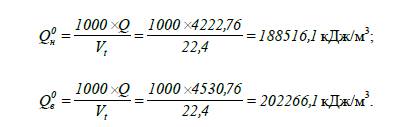
Відповідь:
нижча та вища молярна теплота згоряння гексану становить
4222,76 та 4530,76 кДж/моль відповідно, масова нижча та вища теплота згоряння –
49101,9 та 52683,3 кДж/кг відповідно і об’ємна нижча та вища теплота згоряння
гексану становить 188516,1 та 202266,1 кДж/м3 відповідно.
4.4.Визначення
теплоти згоряння суміші хімічних речовин
Якщо формула хімічної
речовини невідома, а відомий її відсотковий склад, масову теплоту згоряння
визначають за формулою Д. Менделєєва:
ü
вища
теплота згоряння, кДж/кг:
![]()
ü
нижча
теплота згоряння, кДж/кг:
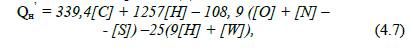
де [С], [Н], [О], [N],
[S], [W] – масовий відсотковий вміст карбону, гідрогену,
оксигену, нітрогену, сульфуру та вологи відповідно у горючій речовині.
Приклад 4.2:
Використовуючи формулу Д. Менделєєва,
визначити нижчу та вищу масову теплоту згоряння амілнітрату (С5Н11О3N)
при стандартних умовах.
Вирішення:
1. Визначаємо
молярну масу амілнітрату:
М(С5Н11О3N)
= 12×5 + 1×11 + 16×3 +
14×1 = 133 г/моль.
2. Визначаємо
масовий відсотковий вміст карбону, гідрогену, оксигену, нітрогену у молекулі
амілнітрату:
133
г/моль – 100 %
12×5
– [С] %
1×11–
[Н] %
16×3–
[О] %
14×1–
[N] %,
звідси:

3. Використовуючи
формулу Д.Менделєєва визначаємо нижчу та вищу масову теплоту згоряння
амілнітрату:
ü вища
теплота згоряння:
Qв’ = 339,4[С] + 1257[Н] – 108,9 ([О]+[N]) =
339,4×45,1 + 1257×8,3 – 108,9×(36,1+10,5) = 20655,3
кДж/кг;
ü нижча
теплота згоряння:
Qн’=339,4[С] + 1257[Н] – 108,9 ([О] + [N] –
[S]) –25(9[Н] + [W]) = 339,4[С] + 1257[Н] – 108,9 ([О] + [N] – [S]) –25(9[Н] + +[W])=339,4×45,1+1257×8,3
– 108,9×(36,1+10,5) –25(9×8,3) = = 18787,8 кДж/кг.
Відповідь:
нижча та вища масова теплота згоряння амілнітрату становить 18787,8 та 20655,3
кДж/кг відповідно.

