ЕЛЕКТРОЛІЗ
ВОДНИХ РОЗЧИНІВ
Крім
катіонів і аніонів, на які дисоціює електроліт, у розчині, на відміну від
розплаву, є ще молекули ![]() , які
можуть відновлюватись на катоді і окиснюватись на аноді.
, які
можуть відновлюватись на катоді і окиснюватись на аноді.
Катодні процеси
(процеси відновлення): на катоді першою відновлюється та електрохімічна
система, потенціал якої більший .
У
нейтральному середовищі потенціал відновлення ![]() становить – 0,41 В (рН = 7).
становить – 0,41 В (рН = 7).
1)
При електролізі водних розчинів солей металів, стандартний потенціал яких
значно менший, ніж – 0,41 В, на катоді відновлюються молекули ![]() і виділяється водень, а іони металу не
відновлюються:
і виділяється водень, а іони металу не
відновлюються:
K: ![]() ,
,
До
таких металі належать метали від початку ряду напруг приблизно до Титану.
2) при електролізі водних розчинів солей
металів, потенціал яких значно більший – 0,41 В, на катоді відновлюються іони
металу:
K: ![]() ,
,
Такі
метали у електрохімічному ряду знаходяться після Стануму.
3) при електролізі водних розчинів солей
металів, потенціал яких близький до – 0,41 В, (від ![]() до
до ![]() ) на
катоді може відновлюватись і
) на
катоді може відновлюватись і ![]() і
і ![]() :
:
K: ![]() ;
;
![]() .
.
Потенціал
відновлення води залежить від рН і
температури, тому змінюючи умови (концентрацію електроліту, температуру,
густину струму, рН розчину) процес
можна вести з переважаючим відновленням або молекул ![]() , або
іонів металу.
, або
іонів металу.
Анодні процеси
(процеси окиснення): на аноді першою окиснюється та електрохімічна система,
потенціал якої менший.
Потрібно
врахувати, що матеріал анода також може брати участь у процесі окислення, якщо
він виготовлений з достатньо активного металу: з міді, алюмінію, нікелю, цинку,
срібла і ін. Такий анод називається активним (розчинним). Неактивний (нерозчинний, інертний) анод –
платиновий, вугільний, графітовий не окислюється.
1)
При електролізі нейтральних розчинів оксигеновмісних кислот та їх солей, а також
фторидів на інертному аноді окиснюється вода (φ =1,23 В), бо потенціал окиснення оксигеновмісних
аніонів і фторидів високий (більший, ніж
+2,5 В):
А:
![]() .
.
2)
У розчині лугу:
А:
![]() ; φ = 0,4–0,8 В при рН>7,
; φ = 0,4–0,8 В при рН>7,
3)
При електролізі розчинів солей без оксигенових кислот (крім фторидів), на
інертному аноді відбувається окиснення аніона:
A: ![]() ;
;
4)
Якщо анод активний, то можливі три процеси: окиснення ![]() ,
аніона та матеріалу анода. Потенціал окиснення аноду завжди менший від
потенціалів окиснення
,
аніона та матеріалу анода. Потенціал окиснення аноду завжди менший від
потенціалів окиснення ![]() чи інших
аніонів, тому відбувається окиснення активного аноду:
чи інших
аніонів, тому відбувається окиснення активного аноду:
A: ![]()
Приклади
1) Електроліз водного розчину нітрату калію з
вугільними (інертними) електродами:
Дисоціація: ![]() ;
; ![]()
Процеси на електродах:
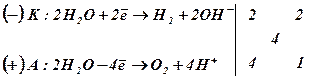
Сумарне
іонне рівняння:
![]()
Молекулярне
рівняння:
![]()
2)
Електроліз розчину калій гідроксиду:
Дисоціація: ![]() ;
;
Процеси
на електродах:
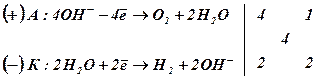
Сумарне
рівняння:
![]()
3)
Електроліз водного розчину сульфату нікелю з активним нікелевим анодом:
Дисоціація:
![]() ;
;
![]() ; Aнод –
; Aнод – ![]()
Процеси
на електродах:
![]()
![]()
![]() .
.

