СТУПІНЬ ЕЛЕКТРОЛІТИЧНОЇ
ДИСОЦІАЦІЇ. КОНСТАНТА ДИСОЦІАЦІЇ
Здатність
електроліту дисоціювати на іони кількісно оцінюють за допомогою ступеня
дисоціації. Ступінь дисоціації
електроліту (![]() )
– це частка молекул, що розпались на іони. Ступінь дисоціації обчислюється як
відношення концентрації дисоційованих молекул (
)
– це частка молекул, що розпались на іони. Ступінь дисоціації обчислюється як
відношення концентрації дисоційованих молекул (![]() ) до
загальної концентрації розчину (
) до
загальної концентрації розчину (![]() ):
):
![]() .
.
Отже,
ступінь дисоціації залежить від концентрації розчину: чим менша концентрація,
тим повніше дисоціює електроліт.
За
величиною ступеня дисоціації 0,001 – 0,1 н розчинів усі електроліти поділяють на сильні і слабкі. До
сильних електролітів належать електроліти,
які у водних розчинах дисоціюють практично повністю, необоротно. Це
майже всі солі, сильні кислоти (![]() ,
, ![]() ,
, ![]() ,
, ![]() ),
сильні основи (основи лужних та лужноземельних металів –
),
сильні основи (основи лужних та лужноземельних металів – ![]() ,
,![]() ,
, ![]() ,
,
![]() ).
).
Наприклад:
кислота: ![]() ;
;
основа: ![]() ;
;
сіль: ![]() .
.
Слабкі
електроліти дисоціюють частково. До них належать органічні кислоти (![]() ),
слабкі неорганічні кислоти (
),
слабкі неорганічні кислоти (![]() ,
, ![]() ,
, ![]() ,
, ![]() ) та
слабкі основи (
) та
слабкі основи (![]() ,
, ![]() ,
, ![]() ).
Дуже слабким електролітом є вода
).
Дуже слабким електролітом є вода ![]() .
Ступінь електролітичної дисоціації визначають експериментально за величиною
ізотонічного коефіцієнта:
.
Ступінь електролітичної дисоціації визначають експериментально за величиною
ізотонічного коефіцієнта:
![]()
де ![]() – ізотонічний коефіцієнт, обчислюється за
температурами кипіння, кристалізації чи за осмотичним тиском розчину (див.
лекцію 11);
– ізотонічний коефіцієнт, обчислюється за
температурами кипіння, кристалізації чи за осмотичним тиском розчину (див.
лекцію 11);
![]() –
число іонів, на які дисоціює одна молекула електроліту.
–
число іонів, на які дисоціює одна молекула електроліту.
Характерною особливістю слабких електролітів
є оборотність їх дисоціації і встановлення хімічної рівноваги між іонами і
недисоційованими молекулами. Наприклад слабка оцтова кислота дисоціює оборотно:
![]() .
.
Стан рівноваги такого оборотного процесу
характеризується константою рівноваги, яка називається константою дисоціації (![]() ):
):
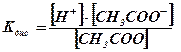 ,
,
де
![]() ,
, ![]() ,
, ![]() –
рівноважні концентрації.
–
рівноважні концентрації.
Між константою (![]() ) і
ступенем дисоціації (
) і
ступенем дисоціації (![]() )
існує залежність, відома як закон
розведення Оствальда:
)
існує залежність, відома як закон
розведення Оствальда:
![]() ,
,
![]() –
концентрація слабкого електроліту, моль/л.
–
концентрація слабкого електроліту, моль/л.
Якщо електроліт є дуже слабким, то ![]() , тоді
, тоді
![]() , а
закон розведення запишеться так:
, а
закон розведення запишеться так:
![]() ;
; ![]() .
.
![]() залежить від природи розчиненої речовини і
розчинника, температури, але не залежить від концентрації розчину. Константа
дисоціації характеризує здатність кислоти чи основи розпадатись на іони: чим
більша константа дисоціації, тим легше дисоціює електроліт, тим сильнішою є
кислота чи основа (див. додаток 3).
залежить від природи розчиненої речовини і
розчинника, температури, але не залежить від концентрації розчину. Константа
дисоціації характеризує здатність кислоти чи основи розпадатись на іони: чим
більша константа дисоціації, тим легше дисоціює електроліт, тим сильнішою є
кислота чи основа (див. додаток 3).
Слабкі багатоосновні кислоти, багатокислотні
основи дисоціюють ступінчасто. Наприклад:
слаба кислота:
І
ступінь: ![]() ;
;
ІІ ступінь:
![]() ;
;
слаба основа:
І ступінь: ![]() ;
;
IІ
ступінь: ![]() .
.
Дисоціація кожної наступної стадії проходить
меншою мірою, ніж попередньої. Відповідно константи дисоціації зменшуються: ![]() >
>![]() >
>![]() …
…

