РОЗЧИННІСТЬ
Розчинність
– це властивість речовини розчинятись в тому або іншому розчиннику. Здатність
до розчинення залежить від природи розчинника, розчиненої речовини,
температури, а для газів – і від тиску.
Залежність розчинності речовин від їх
природи можна описати емпіричним правилом: подібне розчиняється в подібному.
Речовини іонної природи (солі, луги) або речовини, молекули яких є полярними
(спирти, карбонові кислоти), добре розчиняються у полярних розчинниках,
наприклад, у воді. Речовини молекулярної неполярної будови розчиняються у
неполярних розчинниках.
Розчинність
більшості твердих речовин у воді з підвищенням температури збільшується, хоч і
різною мірою. Наприклад розчинність ![]() з підвищенням температури зростає незначно,
з підвищенням температури зростає незначно, ![]() – більш помітно, а
– більш помітно, а ![]() – значно. Взаємна розчинність рідин також
зростає з підвищенням температури. Розчинність газів у рідинах зростає,
навпаки, з пониженням температури і з підвищенням тиску. Відповідно
до закону Генрі-Дальтона: маса газу, що розчиняється, при сталій
температурі в даному об’ємі рідини прямо пропорційна його парціальному тиску:
– значно. Взаємна розчинність рідин також
зростає з підвищенням температури. Розчинність газів у рідинах зростає,
навпаки, з пониженням температури і з підвищенням тиску. Відповідно
до закону Генрі-Дальтона: маса газу, що розчиняється, при сталій
температурі в даному об’ємі рідини прямо пропорційна його парціальному тиску:
![]() ,
,
де ![]() – масова концентрація газу у насиченому розчині;
– масова концентрація газу у насиченому розчині;
![]() – парціальний тиск газу у газовій суміші;
– парціальний тиск газу у газовій суміші;
![]() –
коефіцієнт Генрі (характеризує природу компонентів).
–
коефіцієнт Генрі (характеризує природу компонентів).
Розчинення – оборотній процес, тому для
певних умов встановлюється рівновага:
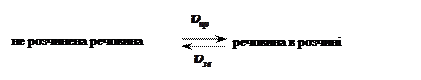 Наприклад,
Наприклад,
![]()
Розчини
бувають насиченими, ненасиченими і перенасиченими.
Насиченим
називається такий розчин, який перебуває у рівновазі з речовиною, яка
розчиняється, ![]() . Концентрація насиченого розчину у грамах
розчиненої речовини на 100 грам
розчинника є мірою розчинності (при даній температурі) і називається
коефіцієнтом розчинності або розчинністю.
. Концентрація насиченого розчину у грамах
розчиненої речовини на 100 грам
розчинника є мірою розчинності (при даній температурі) і називається
коефіцієнтом розчинності або розчинністю.
За
розчинністю у воді (див. додаток 2) всі речовини поділяються на три групи:
1)
добре розчинні (>10 г в 100 г Н2О);
2)
малорозчинні (<1 г в 100 г Н2О);
3)
практично нерозчинні (<0,01
г в 100 г Н2О).
Абсолютно нерозчинних речовин немає.
У ненасиченому розчині міститься менше
речовини, ніж потрібно для насичення при даній температурі.
У перенасиченому розчині міститься більше
речовини, ніж потрібно для насичення при даній температурі.
Перенасичені розчини
нестійкі, внесення затравки сприяє виділенню надлишку розчиненої речовини в
осад і розчин стає насиченим.

