ХІМІЧНА
РІВНОВАГА. КОНСТАНТА РІВНОВАГИ
Всі
хімічні реакції можна поділити на оборотні і необоротні.
Реакції, що відбуваються в одному
напрямку до повної витрати однієї з реагуючих речовин називаються необоротними.
![]()
Оборотними
називаються реакції, які можуть відбуватися і в прямому, і в зворотному
напрямках.
![]()
Більшість хімічних реакцій є оборотними.
Розглянемо їх більш докладно на прикладі утворення ![]() . При
300-4000 С відбувається синтез
. При
300-4000 С відбувається синтез ![]() з
з ![]() і
і ![]() і при цій же температурі відбувається розклад
і при цій же температурі відбувається розклад ![]() .
Зміна швидкості обох цих процесів протягом певного часу показана графіком:
.
Зміна швидкості обох цих процесів протягом певного часу показана графіком:

![]()
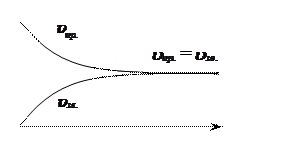
У перший момент часу швидкість прямої
реакції ![]() – максимальна, а зворотної –
– максимальна, а зворотної – ![]() .
У міру взаємодії
.
У міру взаємодії ![]() і
і ![]() утворюється
утворюється ![]() ,
, ![]() .
зменшується, а
.
зменшується, а ![]() –
зростає.
–
зростає.
![]()
Коли
швидкості прямої і зворотної реакції урівнюються, наступає стан хімічної
рівноваги:
![]() .
.
Отже,
хімічною рівновагою називається стан
оборотної реакції, при якому швидкість прямої реакції дорівнює швидкості
зворотної (![]() ).
Концентрації компонентів реакції у стані рівноваги називаються рівноважними концентраціями і
позначаються так
).
Концентрації компонентів реакції у стані рівноваги називаються рівноважними концентраціями і
позначаються так ![]() . Вони
при даній температурі залишаються постійними. З умови рівності швидкостей
прямої і зворотної реакції виводиться константа
рівноваги:
. Вони
при даній температурі залишаються постійними. З умови рівності швидкостей
прямої і зворотної реакції виводиться константа
рівноваги:
![]()
![]() ;
; ![]() ;
; ![]() .
.
![]()
Константа хімічної рівноваги ![]() – це відношення добутку рівноважних
концентрацій продуктів реакції до добутку рівноважних концентрацій реагуючих
речовин у степенях, що дорівнюють їх стехіометричним коефіцієнтам у рівнянні
реакції. Наприклад для наведеної вище реакції утворення гідроген йодиду:
– це відношення добутку рівноважних
концентрацій продуктів реакції до добутку рівноважних концентрацій реагуючих
речовин у степенях, що дорівнюють їх стехіометричним коефіцієнтам у рівнянні
реакції. Наприклад для наведеної вище реакції утворення гідроген йодиду:
![]()
константа
рівноваги залежить від температури, природи реагуючих речовин, але не залежить
від їх концентрацій і від наявності каталізатора.
Константа
рівноваги ![]() пов’язана
з вільною енергією Гіббса співвідношенням:
пов’язана
з вільною енергією Гіббса співвідношенням:
![]() , або
, або ![]() .
.

