Лабораторне
заняття
Тема:ОТРИМАННЯ ТА
ВЛАСТИВОСТІ НАСИЧЕНИХ ТА НЕНАСИЧЕНИХ ВУГЛЕВОДНІВ
Мета: засвоїти метод
якісного визначення елементів, що входять до складу органічних сполук.
Ознайомитись із способами одержання насичених і ненасичених вуглеводнів та їх
специфічними хімічними властивостями. Підкреслити широке практичне застосування
органічних сполук.
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Основні положення хімічної будови органіних сполук О.
Бутлерова.
2. Поняття про гомологічні ряди і функціональні групи.
3. Загальні формули насичених та ненасичених вуглеводнів.
4. Записати гомологічний ряд метану.
5. Які вуглеводні називаються ненасиченими?
6. Основні класи органічних сполук.
7. Хімічні властивості насичених вуглеводнів.
8. Хімічні властивості ненасичених вуглеводнів.
ТЕОРЕТИЧНІ
ВІДОМОСТІ
Органічна хімія – це хімія сполук
Карбону (органічних сполук). Предметом органічної хімії є вивчення складу, будови, властивостей та
різноманітних перетворень органічних речовин. Основою органічної хімії є теорія
хімічної будови органічних сполук О.М. Бутлерова (1861 р.).
Основні положення:
1. У
молекулах атоми сполучені один з одним у певній послідовності відповідно до їх
валентності.
2.
Хімічні та фізичні властивості речовини залежать не лише від кількісного і
якісного складу, але й від будови молекули.
3.
Атоми або групи атомів у молекулах взаємно впливають один на одного
безпосередньо або через інші атоми.
4.
Валентність Карбону у органічних сполуках (число можливих зв’язків) рівна
чотирьом. Атом Карбону знаходиться у збудженому стані і має електронну
конфігурацію ![]() .
.
5. ![]()
![]() Атоми
Карбону здатні сполучатись один з одним, утворюючи карбонові ланцюги
необмеженої довжини.
Атоми
Карбону здатні сполучатись один з одним, утворюючи карбонові ланцюги
необмеженої довжини.
Між
атомами Карбону у молекулах можуть
існувати одинарні ![]() , подвійні
, подвійні ![]() або потрійні
або потрійні ![]() зв’язки. Ланцюги з
атомів Карбону можуть бути відкритими, розгалуженими, замкнутими.
зв’язки. Ланцюги з
атомів Карбону можуть бути відкритими, розгалуженими, замкнутими.
Органічні сполуки, які
складаються тільки з атомів Карбону і Гідрогену, називаються вуглеводнями.
Існують також похідні вуглеводнів, до складу яких замість атома Гідрогену
входять різні функціональні групи (замісники). Функціональні групи надають речовинам певних
хімічних властивостей. Особливо поширеними є:
− ![]() гідроксильна група
спиртів і фенолів;
гідроксильна група
спиртів і фенолів;
![]()

− ![]() аміногрупа
первинних амінів;
аміногрупа
первинних амінів;
− ![]() нітрогрупа нітросполук.
нітрогрупа нітросполук.
Органічні сполуки кожного типу утворюють гомологічні
ряди. Гомологічним рядом називається
послідовний ряд однотипних органічних сполук, коли кожна наступна відрізняється від попередньої на групу атомів
![]() , яку називають гомологічною різницею.
, яку називають гомологічною різницею.
Склад будьякого члена гомологічного ряду можна
знайти за допомогою загальних формул. Загальна формула гомологічного ряду
насичених вуглеводнів – алканів – ![]() (таблиця 6), ненасичених з одним подвійним зв’язком
(етиленових) – алкенів –
(таблиця 6), ненасичених з одним подвійним зв’язком
(етиленових) – алкенів – ![]() (
(![]() етен (етилен),
етен (етилен), ![]() ,
пропен (пропілен)), ненасичених з двома подвійними зв’язками (дієнових) – алкадієнів
–
,
пропен (пропілен)), ненасичених з двома подвійними зв’язками (дієнових) – алкадієнів
– ![]() (
(![]() бутадієн-1,3), ненасичених з одним потрійним зв’язком (ацетиленових) – алкінів
–
бутадієн-1,3), ненасичених з одним потрійним зв’язком (ацетиленових) – алкінів
– ![]() (
(![]() етин (ацетилен),
етин (ацетилен), ![]() пропін (метилацетилен)); загальна формула
похідних бензену – аренів (ароматичних вуглеводнів)
пропін (метилацетилен)); загальна формула
похідних бензену – аренів (ароматичних вуглеводнів) ![]() (n ≥ 6) (
(n ≥ 6) (![]() бензен (бензол)).
бензен (бензол)).
Вуглеводневими радикалами називають залишки, утворені
послідовним відніманням від молекул вуглеводню атомів Гідрогену. Вони мають одну або кілька вільних валентностей.
Нижче подані вуглеводні гомологічного ряду метану і відповідні їм радикали.
Таблиця 6
Гомологічний ряд метану
|
Насичені
вуглеводні - алкани СnH2n+2 |
Одновалентні
радикали |
|
Метан СН4 |
Метил СН3 — |
|
Етан С2Н6 |
Етил С2Н5 — |
|
Пропан С3Н8 |
Пропіл С3Н7 — |
|
Бутан С4Н10 |
Бутил С4Н9 — |
|
Пентан С5Н12 |
Аміл С5Н11 — |
|
Гексан С6Н14 |
Гексил С6Н13 — |
|
Гептан С7Н16 |
Гептил С7Н15 — |
|
Октан С8Н18 |
Октил С8Н17 — |
|
Нонан С9Н20 |
Нонил С9Н19 — |
|
Декан С10Н22 |
Децил С10Н21 — |
Спирти – похідні вуглеводнів, у молекулах яких один або
декілька атомів Карбону заміщені на гідроксогрупу ![]() :
:
- одноатомні спирти, закінчення -ол: метанол (метиловий спирт) ![]() , етанол (етиловий спирт)
, етанол (етиловий спирт) ![]() ;
;
-
двоатомні спирти – гліколі: етиленгліколь ![]() ;
;
-
триатомні спирти: гліцерин ![]() .
.
Альдегіди і кетони – похідні вуглеводнів, у молекулах яких атом
Гідрогену заміщений на одну або кілька карбонільних груп ![]() :
:
- альдегіди
(закінчення -аль):
метаналь (формальдегід) етаналь (ацетальдегід)
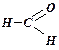
![]()
-
кетони (закінчення -он):
пропанон (ацетон)
![]()
Карбонові кислоти – похідні вуглеводнів, у молекулах яких один або
кілька атомів Гідрогену заміщені на карбоксильні групи ![]() . Одноосновні органічні кислоти:
. Одноосновні органічні кислоти:
![]()
![]()
метанова (мурашина) кислота етанова (оцтова) кислота
Двоосновні
органічні кислоти ![]() :
:
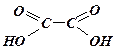
щавелева
(оксалатна) кислота
Карбонові
кислоти у водних розчинах дисоціюють з утворенням іона ![]() з
карбоксильної групи:
з
карбоксильної групи:
![]() .
.
Етери (прості ефіри) – похідні спиртів, у молекулі яких атом Гідрогену
гідроксогрупи ![]() заміщений на
карбоновий радикал
заміщений на
карбоновий радикал ![]() :
:
диметилетер
диетилетер (диметиловий ефір) (диетиловий ефір)
![]()
![]()
Естери (складні ефіри) – продукти заміщення атомів Гідрогену
карбоксильної групи карбонових кислот на карбоновий радикал ![]() :
:
оцтовоетиловий естер або етилацетат (етиловий ефір оцтової кислоти)
![]()
Нітросполуки – похідні вуглеводнів, у молекулах яких один або
кілька атомів Гідрогену заміщені на нітрогрупу ![]() :
:
нітрометан нітроетан
![]()
![]()
Аміни – це похідні аміаку, у молекулах якого один або кілька атомів
Гідрогену заміщені на вуглеводневі радикали, наприклад:
- первинний амін
![]() (метиламін)
(метиламін)
- вторинний
амін ![]() (диетиламін)
(диетиламін)
Сполуки з кількома різними функціональними групами
називаються сполуками зі змішаними функціями:
аміноспирти
амінокислоти
![]()
![]()
Хімічні властивості вуглеводнів
У хімічному відношенні насичені вуглеводні за
звичайних умов малоактивні. Для них характерні реакції:
- заміщення: ![]() ;
;
- горіння: ![]() (повне згоряння);
(повне згоряння);
![]() (неповне згоряння);
(неповне згоряння);
t
- розпаду:
![]() (термічна
дисоціація)
(термічна
дисоціація)
![]() (каталітичний розпад)
(каталітичний розпад)
Ненасичені вуглеводні (алкени, алкіни, алкадієни)
хімічно активніші, ніж алкани. Для них характерні реакції:
- приєднання:
![]() (галогенування);
(галогенування);
![]() (гідрування);
(гідрування);
![]() (гідратація);
(гідратація);
(реакція Кучерова)
![]()
- окиснення
в розчині:
етиленгліколь
![]()
щавлева кислота
![]()
- горіння:![]() (повне
горіння);
(повне
горіння);
![]() (неповне
горіння);
(неповне
горіння);
-
полімеризації:
етилен поліетилен
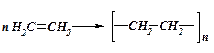
ПРИКЛАДИ
РОЗВ’ЯЗУВАННЯ ЗАДАЧ
1. Записати рівняння реакції повного і неповного горіння
гексану.
Розв’язання.
Під час повного горіння гексану (надлишок кисню)
утворюється вуглекислий газ та вода. При неповному горінні гексану (недостача
кисню) утворюється чадний газ та вода:
![]() – повне горіння;
– повне горіння;
![]() – неповне горіння.
– неповне горіння.
ЕКСПЕРИМЕНТАЛЬНА
ЧАСТИНА
Дослід 1. Якісне визначення
вуглецю і водню
На дно сухої пробірки насипають біля
Дослід 2. Якісне визначення галогенів в органічних
сполуках
Мідний дріт закручують на кінці в спіраль, прожарюють цей
кінець дроту в полум’ї пальника, ще теплим занурюють в органічну сполуку, що
містить галоген, наприклад, у хлороформ ![]() і швидко вносять знову
у полум’я пальника, яке забарвлюється в яскраво зелений колір.
і швидко вносять знову
у полум’я пальника, яке забарвлюється в яскраво зелений колір.
Дослід 3. Одержання та властивості метану
У суху пробірку з газовідвідною трубкою насипають 1/4 її
об’єму суміші, яка складається з однієї частини зневодненого ![]() та двох частин попередньо прожареного
натронного вапна. Пробірку з сумішшю нагрівають полум’ям
пальника. Спочатку прогрівають всю пробірку, а потім сильно нагрівають суміш.
Газ, що виділяється, пропускають в окремій пробірці з розчином
та двох частин попередньо прожареного
натронного вапна. Пробірку з сумішшю нагрівають полум’ям
пальника. Спочатку прогрівають всю пробірку, а потім сильно нагрівають суміш.
Газ, що виділяється, пропускають в окремій пробірці з розчином ![]() . Який газ виділяється? Чи змінюється забарвлення розчину?
Чому? Записати рівняння реакції повного і неповного горіння метану.
. Який газ виділяється? Чи змінюється забарвлення розчину?
Чому? Записати рівняння реакції повного і неповного горіння метану.
Дослід 4. Одержання та властивості етилену
У
суху пробірку з газовідвідною трубкою наливають 5-6 мл завчасно приготовленої суміші, що складається з однієї частини
етилового спирту та трьох частин концентрованої сульфатної кислоти, і кидають
маленький кусочок пемзи для рівномірного кипіння суміші. Пробірку закривають
пробкою з газовідвідною трубкою і суміш обережно нагрівають. Газ, що
виділяється, пропускають в окремій пробірці з розчином ![]() . Який газ виділяється? Чи змінюється забарвлення розчину?
Чому? Записати рівняння реакцій. Записати рівняння реакції повного і неповного
горіння етилену.
. Який газ виділяється? Чи змінюється забарвлення розчину?
Чому? Записати рівняння реакцій. Записати рівняння реакції повного і неповного
горіння етилену.
Дослід 5. Одержання та властивості ацетилену
У суху пробірку з газовідвідною трубкою поміщають 2-3
кусочки кальцій карбіду і наливають 1/3 води. Пробірку швидко закривають корком
з газовідвідною трубкою. Газ, що виділяється, пропускають в окремій пробірці з
розчином ![]() . Який
газ виділяється? Чи змінюється забарвлення розчину? Чому? Записати рівняння
реакцій. Записати рівняння реакції повного і неповного горіння ацетилену.
. Який
газ виділяється? Чи змінюється забарвлення розчину? Чому? Записати рівняння
реакцій. Записати рівняння реакції повного і неповного горіння ацетилену.
ЗАДАЧІ
ТА ВПРАВИ
1. Показати класифікацію вуглеводнів за формою вуглецевого
ланцюга та характером ![]() зв’язку.
зв’язку.
2. Написати і назвати три приклади органічних сполук з
різними функціональними групами.
3. Написати реакції хлорування етану, етилену, ацетилену та
бензолу.
Написати
реакції гідратації (приєднання води) етилену, пропілену, ацетилену.

