Лабораторне
заняття
Тема:
КОРОЗІЯ МЕТАЛІВ
Мета
заняття: ознайомитися з механізмом процесів
корозії. Дослідити вплив різних факторів на процес корозії металів. Відзначити
значні витрати, яких завдає корозія народному господарству, і засвоїти способи боротьби
з корозією металів.
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Що
таке корозія металів? Основні види корозії металів.
2. Механізм електрохімічної корозії. Катодні і
анодні процеси при корозії у різних середовищах.
3. Корозія, що виникає внаслідок нерівномірної
аерації.
4. Способи захисту
металів від корозії.
ТЕОРЕТИЧНІ
ВІДОМОСТІ
Металеві матеріали – метали і сплави на основі металів
зазнають руйнування, хімічно взаємодіючи з навколишнім середовищем.
Процес
самовільного руйнування (окиснення) металів під впливом навколишнього
середовища називається корозією. При
цьому метал перетворюється у хімічну сполуку: оксид, гідроксид чи сіль:
![]() .
.
За
механізмом окиснення металів чи сплавів корозія поділяється на хімічну і
електрохімічну.
Хімічна корозія
відбувається в середовищі агресивного газу або розчину неелектроліту, як
правило, при високих температурах.
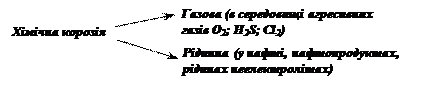
Електрохімічна
корозія – окиснення металу у струмопровідному
середовищі.
Умови
необхідні для розвитку електрохімічної корозії:
-
наявність електроліту (струмопровідного середовища);
-
різниця потенціалів.
Механізм
електрохімічної корозії полягає в анодному руйнуванні (окисненні) металу в
результаті утворення і роботи гальванічного корозійного короткозамкнутого
елемента. В процесі роботи цього елемента метал, який буде анодом,
окиснюватиметься:
(А): Me – nē = Me n+
На катоді
відбувається процес відновлення середовища. Залежно від середовища він може
носити характер водневої або кисневої деполяризації.
Воднева
деполяризація на катоді (К): ![]() ;
;
Киснева
деполяризація на катоді (К): ![]() .
.
Іони чи
молекули, які відновлюються на катоді, називаються деполяризаторами. При корозії в кислому середовищі деполяризаторами
будуть іони Н+, при атмосферній корозії (у вологому повітрі),
корозії в грунті, у воді, що містить розчинений кисень, деполяризатором буде
кисень.
ПРИКЛАДИ
РОЗВ’ЯЗУВАННЯ ЗАДАЧ
Приклад 1. Як відбувається
корозія цинку, що знаходиться в контакті з кадмієм:
а) в
нейтральному розчині, що містить кисень;
б) в
кислому розчині.
Складіть
схеми корозійних елементів та рівняння процесів,
що відбуваються на електродах. Який склад продуктів корозії ?
Розв’язок. Складаємо
схеми гальванічних корозійних елементів та записуємо процеси, що відбуваються
на катоді і аноді. Цинк має більш негативний потенціал (– 0,76 В), ніж кадмій (– 0,4 В), тому
він є анодом, а кадмій – катодом.
а) Схема
корозійного елемента, коли метали контактують в нейтральному середовищі, що містить кисень:
ē
![]()
![]()
(- А) Zn ½H2O, O2 ½ Cd (K +)
Анодний
процес: (А): ![]() .
.
Катодний
процес: (К): ![]() .
.
Продуктом корозії буде ![]() .
.
ē
б) Схема корозійного елемента, коли метали контактують в кислому
розчині:
![]()
(- А) Zn½H+ ½Cd (K +)
Анодний
процес: (А): ![]() .
.
Катодний
процес: (К): ![]() .
.
Продуктом
корозії будуть іони ![]() в розчині.
в розчині.
ЕКСПЕРИМЕНТАЛЬНА
ЧАСТИНА
Дослід 1. Утворення окалини на міді та залізі
Нагріти очищені наждачними папером залізну і мідну
пластинки в полум’ї пальника на протязі 5 хв.
Спостерігати зміну кольору пластин внаслідок окислення. Записати рівняння
реакцій. До якого виду корозії відноситься цей процес?
Дослід
2. Корозія на контакті двох різних
металів
В пробірку налити розбавлений розчин хлоридної або
сульфатної кислоти і опустити шматочок цинку. Відмітити інтенсивність виділення
водню. Доторкнутися мідною дротинкою до цинку в пробірці. Як змінюється
інтенсивність виділення водню і на якому з металів він виділяється?
Пояснити спостереження, врахувавши, що ![]() i
i ![]() утворюють гальванічну пару. Подати схему
гальванічного елемента, записати процеси, що відбуваються на електродах,
вказати напрямок переходу електронів у парі
утворюють гальванічну пару. Подати схему
гальванічного елемента, записати процеси, що відбуваються на електродах,
вказати напрямок переходу електронів у парі ![]() .
.
Дослід
3. Корозія при нерівномірній аерації
поверхні металу
В пробірку налити 1 мл
розчину ![]() , 0,5 мл розчину
, 0,5 мл розчину ![]() i 5-6 крапель
фенолфталеїну. На чисту поверхню залізної пластинки нанести паличкою
приготовленого реактиву. Спостерігати появу синього забарвлення в центрі краплі
і рожевого на її краях. Написати рівняння реакцій, що відбуваються на анодній і
катодній ділянках краплі.
i 5-6 крапель
фенолфталеїну. На чисту поверхню залізної пластинки нанести паличкою
приготовленого реактиву. Спостерігати появу синього забарвлення в центрі краплі
і рожевого на її краях. Написати рівняння реакцій, що відбуваються на анодній і
катодній ділянках краплі.
Дослід 4.
Корозія оцинкованого і лудженого заліза
Налити в дві пробірки по 3-4 мл 2н. розчину сульфатної кислоти і по три краплі червоної
кров’яної солі ![]() , що є чутливим реактивом на іони
, що є чутливим реактивом на іони ![]() . При наявності іонів
. При наявності іонів ![]() розчин забарвлюється в
синій колір. Розчин перемішати скляною паличкою. В одну пробірку опустити
смужку оцинкованого заліза, а в другу — покритого оловом, міддю або
нікелем. В якій пробірці утворюється через деякий час синє забарвлення?
Написати рівняння реакцій. Скласти схеми гальванічних корозійних елементів, що
виникають при порушенні суцільності покриття. Вказати тип захисного покриття
(анодне чи катодне).
розчин забарвлюється в
синій колір. Розчин перемішати скляною паличкою. В одну пробірку опустити
смужку оцинкованого заліза, а в другу — покритого оловом, міддю або
нікелем. В якій пробірці утворюється через деякий час синє забарвлення?
Написати рівняння реакцій. Скласти схеми гальванічних корозійних елементів, що
виникають при порушенні суцільності покриття. Вказати тип захисного покриття
(анодне чи катодне).
Дослід
5. Дія іонів, що активують процес корозії
У дві пробірки помістити по смужці алюмінієвої фольги і
налити по 1-2 мл розчину ![]() з декількома краплями
2 Н
з декількома краплями
2 Н ![]() . В одну пробірку внести трохи розчину натрій хлориду.
Пояснити явища, що спостерігаються.
. В одну пробірку внести трохи розчину натрій хлориду.
Пояснити явища, що спостерігаються.
ЗАДАЧІ
ТА ВПРАВИ
1. Складіть
рівняння анодного і катодного процесів з водневою і кисневою деполяризацією при
корозії на контакті магній–нікель. Які
продукти корозії утворюються в першому і другому випадках?
2. Якщо
цвях вбити у вологе дерево, то іржею покривається та його частина, яка
міститься всередині дерева. Чим це можна пояснити? Анодом чи катодом є ця
частина цвяха? Складіть електронні рівняння відповідних процесів.
3. Складіть
схеми гальванічних корозійних елементів та рівняння приелектродних процесів з
кисневою і водневою деполяризацією при корозії пари алюміній–залізо. Які
продукти корозії утворюються в першому і другому випадках?
4. Як
відбувається атмосферна корозія заліза, покритого шаром нікелю, якщо покриття
порушено? Складіть рівняння анодного і катодного процесів. Який склад продуктів
корозії?
5. Залізний
виріб покрили свинцем. Яке це покриття –
анодне чи катодне? Чому? Складіть схеми корозійних елементів та рівняння
приелектродних процесів корозії цього виробу при порушенні покриття у вологому
повітрі і в розчині хлоридної кислоти. Які продукти утворюються в першому і
другому випадках?
6.
Написати рівняння процесів, що відбуваються при
електрохімічній корозії на контакті цинк –
мідь у вологій атмосфері.
7.
Наведіть приклад анодного і катодного покриття
заліза для запобігання корозії. Складіть рівняння реакцій, що відбуваютося біля
поверхні заліза і біля поверхні захисного шару, якщо цілісність шару порушена.
8.
Записати рівняння процесів, що відбуваються при
корозії технічного заліза у вологій атмосфері.
9. Який
метал доцільніше вибрати для протекторного захисту від корозії свинцевої
оболонки кабеля: цинк, магній чи хром? Чому? Складіть схему корозійного
елемента і рівняння анодного і катодного процесів атмосферної корозії. Який
склад продуктів корозії?
10.
Дві залізні пластинки,
частково покриті одна оловом, інша міддю, знаходяться у вологому повітрі. На
якій з цих пластинок швидше утворюється іржа? Чому? Складіть схеми корозійних
елементів і рівняння анодного і катодного процесів корозії цих пластинок. Який
склад продуктів корозії заліза?

