Т.5. Розподіл
електронів у атомі за квантовою теорією
§ 1. Дослід Штерна і Герлаха
(1921)
Мета досліду: визначити напрямок магнітних моментів електронів в атомі
відносно зовнішнього магнітного поля. Атомами, що використовувались в
експерименті були атоми першої групи хімічних елементів (Cu,
Ag, Au) з одним валентним
електроном на зовнішній орбіті (магнітні моменти внутрішніх валентних
електронів протилежно направлені та скомпенсовані). 3 огляду на вищесказане, магнітний
момент таких атомів приблизно дорівнює магнітному моменту валентного електрона.
Схема експерименту представлена на рис. 5.1. Зразок срібла, нагрітий до
високої температури і випромінюючий атоми зі швидкістю близько 100 м/с,
поміщають в камеру з низьким тиском, близько 10-5 мм рт. ст. (щоб уникнути розсіювання атомів срібла на
молекулах повітря). Атоми срібла, що пролітали в неоднорідному магнітному полі,
осідали на фотопластинку. Середньоквадратична швидкість атомів срібла залежить
від температури зразка як
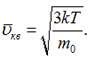
У неоднорідному
магнітному полі ці атоми зазнають дії сили
![]()
що спотворювала траєкторію пучка атомів. Тут ![]() проекція магнітного моменту атомів срібла в
напрямку осі Z.
проекція магнітного моменту атомів срібла в
напрямку осі Z.
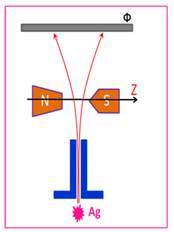
Рис. 5.1.
Якщо магнітні моменти електронів в атомах у зовнішньому магнітному
полі орієнтовані згідно з класичною теорією, то цей експеримент виявить високу
густину розподілу атомів у центрі фотопластинки (рис. 5.2.).
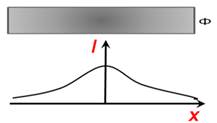
Рис. 5.2
Експеримент же дав такі результати. Відхилення атомів в
магнітному полі відповідає лише двом можливим орієнтаціям їх магнітного моменту
та відповідно валентних електронів у них в зовнішньому магнітному полі (рис.
5.3).
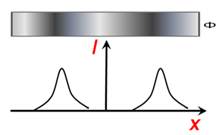
Рис. 5.3
Сила, що
діє на атом срібла під дією неоднорідного магнітного поля, була розрахована по
радіусу кривини траєкторії орбіталей за формулою доцентрової сили:
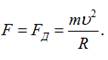
Неоднорідність
магнітного поля dB/dZ була
відома заздалегідь, а проекція магнітного моменту атома (валентного електрона)
у напрямку зовнішнього магнітного поля була знайдена шляхом порівняння двох
останніх формул:
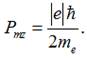
Величину
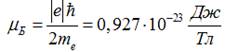
називають
магнетоном Бора.
Цей
експеримент підтвердив дискретність (бо ![]() ) і
просторове квантування (дві можливі орієнтації) магнітних моментів атома і його
електронів у зовнішньому магнітному полі.
) і
просторове квантування (дві можливі орієнтації) магнітних моментів атома і його
електронів у зовнішньому магнітному полі.
§2. Спін
електрона та спінове квантове число
Просторове квантування та
дискретність значень магнітного моменту електрона в атомі можна пояснити на
основі нового поняття спіну для електрона (рис. 5.4).
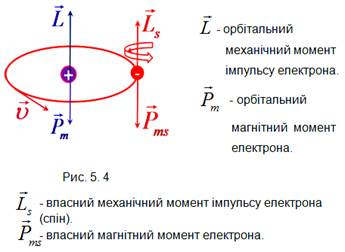
Спін електрона є ще однією
властивістю крім його заряду та маси і є величиною квантованою:
![]()

Проекція спіну на вісь Oz, яка співпадає з напрямком зовнішнього магнітного поля, є
також квантованою:
![]()
![]()
На рисунку 5.5 представлено графічне зображення проекції спіну на напрям зовнішнього магнітного поля.
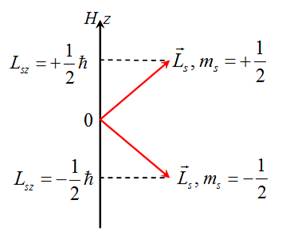
Рис. 5.5
§ 3 Принцип Паулі. Фемі- та бозе-частинки.
Повна хвильова функція системи однакових частинок називається симетричною,
якщо знак повної хвильової функції не змінюється при заміні пари таких
частинок.
Повна хвильова функція
системи двох однакових частинок називається антисиметричною, якщо її знак
змінюється на протилежний при аналогічній заміні двох однакових частинок
системи. Вид повної хвильової функції системи однакових частинок залежить
тільки від величини проекції спіну цих частинок на
напрямок зовнішнього магнітного поля.
Для частинок, проекція
спіну яких на напрямок зовнішнього магнітного поля
дорівнює парному числу ![]() , хвильова функція є
антисиметричною і такі частинки називаються ферміонами
або частинками, які мають напівцілий спін (наприклад,
електрони). Частинки зі спіновою проекцією, що дорівнює нулю або парному числу
, хвильова функція є
антисиметричною і такі частинки називаються ферміонами
або частинками, які мають напівцілий спін (наприклад,
електрони). Частинки зі спіновою проекцією, що дорівнює нулю або парному числу ![]() , називаються бозонами
або частинками, які мають цілий спін (наприклад, протони).
, називаються бозонами
або частинками, які мають цілий спін (наприклад, протони).
Принцип Паулі: у будь-якому атомі не може бути двох електронів в одному
стаціонарному стані, який визначається набором з чотирьох однакових квантових
чисел n,
l,
m,
ms. Для бозонних систем принцип Паулі не діє.
§4. Розподіл електронів в атомі
Правила відбору та відповідно
можливі значення квантових чисел для електронів в атомах є наступними:
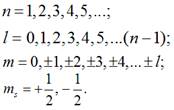
Враховуючи дані правила відбору, можна побудувати таблицю для
максимального числа станів електрона в атомі з різним значенням головного
квантового числа для електрона:
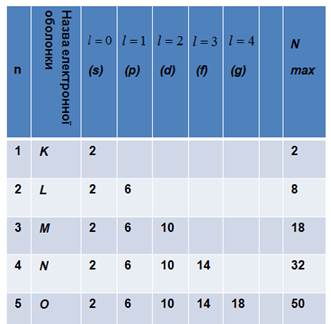
Як слідує
з таблиці, максимальну кількість електронів, що є на електронній оболонці можна
задати виразом:
![]()
Можливі стани електронів з однаковим головним квантовим числом n утворюють електронний шар (електронну
оболонку). Електрони з однаковим значенням n
та l називаються еквівалентними.
Число еквівалентних електронів позначається через z. Електронна конфігурація
ідеального атома виглядає наступним чином:
![]()