Т.1. Будова атома за Резерфордом та Бором
§1. Досліди Резерфорда з
розсіювання
α- частинок. Ядерна
модель атома
І. І. Дослід Резерфорда з розсіювання α- частинок
α- частинки
являють собою продукт радіоактивного розпаду деяких атомів і аналогічні до
двічі іонізованого атома гелію (ядро гелію). Такі частинки, у вигляді тонкого
пучка, що випромінюються із джерела, проходячи через тонку золоту фольгу,
змінюють напрям свого руху, як показано на схемі (рис. 1.1).
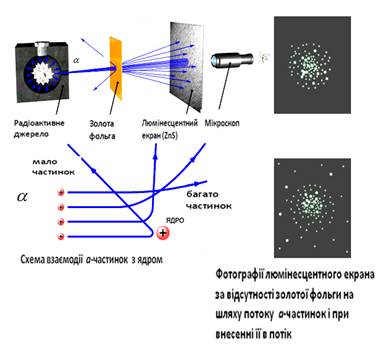
Рис. 1.1
Результати
експерименту
1. Більшість α-частинок мало
відхилялись від попереднього напряму.
2. Невелика кількість
α-частинок відхилялись на великі кути, аж до 140-160 градусів.
Інтерпретація
результатів за Резерфордом
1. Весь позитивний заряд атома зосереджений в його ядрі, яке
складає основну частину маси атома.
2. Об’єм ядра дуже малий в порівнянні з об’ємом атома.
3. Значне відхилення α-частинок від попереднього напряму
відбувається лише при проходженні їх поблизу позитивного масивного ядра.
4. Через малий об’єм ядра ймовірність проходження
α-частинок безпосередньо біля нього дуже мала, що і підтверджується малою
кількістю α-частинок, розсіяних на великі кути.
І. ІІ. Ядерна модель атома за Резерфордом
1. В ядрі
малого об’єму, з лінійними розмірами 10-15 – 10-14 метра,
зосереджено весь позитивний заряд атома і практично вся його маса.
2.
Навколо ядра, в просторі з лінійними розмірами 10-10 метра,
рухаються від’ємно
заряджені електрони, маса яких дуже мала у порівнянні з масою атома:
![]()
3.
Електрони рухаються по орбітах, подібно до планет, що рухаються навколо Сонця.
Таку модель атома ще називають “ планетарною моделлю ”.
4. Орбіти
електронів у атомі дискретні і стаціонарні (винятково стійкі в часі),
незважаючи на рух електронів по колу (рис. 1.2).

Рис. 1. 2
Планетарна модель атома за Резерфордом
§2. Лінійчатий спектр
атома водню. Серіальна формула. Спектральний терм
ІІ.І. Спектральний аналіз
Спектр (від латинського Spectare
- дивитися) - розподіл потоку
випромінювання або частинок за довжинами хвиль або енергією.
Розрізняють три види оптичних спектрів: лінійчаті, смугасті, суцільні.
Лінійчатий спектр
випромінювання
дає речовина у
атомарному стані:
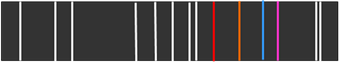
Смугастий
спектр випромінювання
дає
речовина у молекулярному стані:

Суцільний
спектр випромінювання
дає
речовина у твердому стані:

Рис. 1. 3
ІІ.ІІ. Серіальна формула
У 1885 році швейцарський фізик І. Бальмер
встановив, що довжини хвиль ліній видимої
частини спектру випромінювання для атомарного водню можна обчислити за серіальною
формулою :
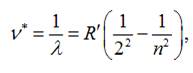
де n = 3, 4, 5, 6, … 11 (9
ліній);
![]() = 1,097 · 107 м-1 - постійна Рідберга
для довжин хвиль;
= 1,097 · 107 м-1 - постійна Рідберга
для довжин хвиль;
![]() - хвильове
число (кількість довжин хвиль, що вміщаються в 1 метрі);
- хвильове
число (кількість довжин хвиль, що вміщаються в 1 метрі);
![]() - довжина
хвилі.
- довжина
хвилі.
Враховуючи співвідношення між частотою і довжиною
електромагнітної хвилі:
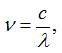
де с =
3 · 108 м/с - швидкість світла у вакуумі, серіальну формулу для частотвидимої області спектру випромінювання
атомарного водню запишемо:
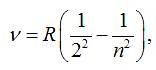
де R = R’· c = 3,29· 1015c-1 - постійна Рідберга
для частот.
Усі лінії спектра випромінювання для
атомів, які випромінюють внаслідок переходу електронів у них з будь-якої n-ної орбіти (енергетичного рівня) на певну з номером m, створюють
серію. Довжини хвиль чи частоти для певної серії визначаються узагальненими серіальними
формулами:
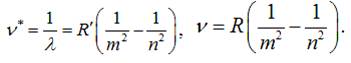
Дані
серії мають свої власні назви:
1. Серія Лаймана
(m=1, n=2,3,4...). Дана серія спостерігається в ультрафіолетовій області
спектра;
2. Серія Бальмера (m=2, n=3,4,5...).
Ця серія знаходиться у видимій області спектру;
3. Серія Пашена (m=3, n=4,5,6...).Дана
серія спостерігається в інфрачервоній області спектра;
4. Серія Брекета (m=4, n=5,6,7...).
Серія в близкій
інфрачервоній області.
5. Серія Пфунда (m=5, n=6,7,8...).
Серія в далекій інфрачервоній області.
Зауваження. Якщо заряд ядра хімічного елемента рівний Z, тоді постійна Рідберга
в серіальній
формулі матиме вигляд:
![]()
На енергетичній діаграмі вищезгадані серії випромінювання атома
водню можна представити, як на рисунку 1. 4.
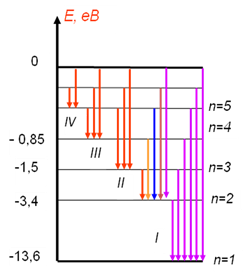
Рис. 1. 4
Спектр атома водню: І – серія Лаймана; ІІ – серія
Бальмера;
ІІІ – серія Пашена; ІV – серія Брекета; V – серія Пфунда.
ІІ. III. Спектральний терм. Комбінаційний принцип Рітца
Р. Рідберг показав, що частоти всіх ліній
певної серії спектру випромінювання задовольняють співвідношення:
![]()
де m і n – цілі
числа, причому n>m.
Функції
T(m) і T(n) називають спектральними
термами.
Відповідно
до серіальної
формули і виразу (1) спектральні терми
наберуть вигляду:
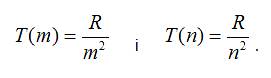
У 1908 році В. Рітц
сформулював так званий комбінаційний принцип:для
довільного атома частоти ліній його випромінювання рівні різниці двох терм.
Комбінація термів дозволить знайти весь спектр випромінювання даного атома.
§3. Постулати Бора. Енергія зв’язку
електрона у атомі водню
ІІІ. І. Постулати Бора
В 1913 році Н. Бор об’єднав у одну теорію ядерну модель
Резерфорда, лінійчатий характер спектрів і квантовий характер випромінювання.
Результатом такого об’єднання стали постулати Бора.
Перший постулат Бора: існують певні стаціонарні стани атома,
перебуваючи в яких він не випромінює і не поглинає енергію. Цим станам атома
відповідають стаціонарні орбіти електронів.
Правило квантування орбіт за Бором: у
стаціонарному стані атома електрон, рухаючись по коловій орбіті, повинен мати
наступні значення, які кантуються, моменту імпульсу:
![]()
де m - маса вільного електрона;
![]() - його лінійна швидкість на орбіті;
- його лінійна швидкість на орбіті;
![]() - радіус
електронної орбіти в атомі;
- радіус
електронної орбіти в атомі;
n - номер орбіти;
![]() - постійна Планка (h = 6.63 · 10-34 Дж·с).
- постійна Планка (h = 6.63 · 10-34 Дж·с).
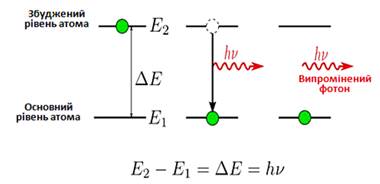
Другий постулат Бора: при
переході атома з одного стаціонарного стану в інший відбувається випромінювання
або поглинаннякванту
світла. Енергія випромінюється при переході із стану з більшою енергією в стан
з меншою енергією і поглинається у зворотному процесі (рис. 1. 5).
![]()
![]()
Рис. 1. 5
ІІІ.ІІ. Енергія зв’язку електрона в атомі водню
Внаслідок переходу електрона в атомі з рівня з більшою енергією
на рівень з меншою енергією відповідно до постулатів Бора, випромінюється квант
світлової енергії:
![]()
Згідно з серіальною
формулою:
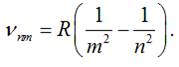
Співставляючи дані формули отримуємо:
![]()
Отже, енергія електрона в атомі водню у певному стаціонарному
стані (або енергія зв’язку електрона в атомі у певному стаціонарному
стані) визначається виразом:
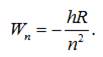
Число n,
яке визначає номер енергетичного рівня атома водню (електрона в атомі),
називається головним квантовим
числом.
§4. Теорія Бора для водневоподібних
систем
Водневоподібною системою
або ізоелектронною
системою називають систему, яка складається з ядра із зарядом ![]() і одного електрона (
і одного електрона (![]() ), який
рухається навколо такого ядра.
), який
рухається навколо такого ядра.
Прикладом ізоелектронної
системи є однократно іонізований атом гелію ![]() :
:
![]()
ІV. І. Радіус n-ної
орбіти електрона у атомі
1. За
Бором на електрон у атомі діють відцентрова сила та сила кулонівської взаємодії.
Для забезпечення стабільної колової орбіти дані сили повинні бути рівними за
абсолютними значеннями ( див. рис. 1. 6).
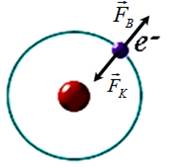
Рис. 1. 6
У
відповідності з такою умовою:
![]() .
.
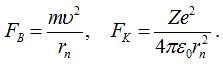
2.
Враховуючи, що
![]() ,
,
умову
рівності сил запишемо:
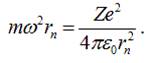
З останньої
формули знайдемо куб радіуса орбіти електрона у атомі:
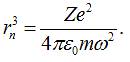
3. За
правилом Бора про квантування орбіт знайдемо ![]() :
:
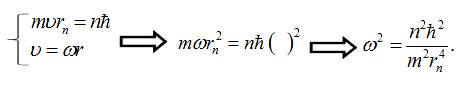
Підставимо
одержане значення ![]() у формулу для куба радіуса орбіти електрона:
у формулу для куба радіуса орбіти електрона:
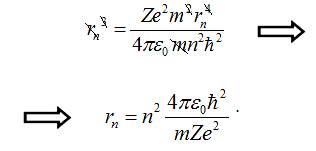
Одержали вираз для радіуса n-ної
орбіти електрона в атомі.
Зауваження: для атома водню, якщо n=1
, значення:
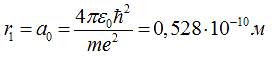
називають
першим борівським радіусом.
ІV. ІІ. Енергія електрона у водневоподібному
атомі
За квантово-механічною моделлю, повна енергія електрона в
атомі рівна сумі його кінетичної і
потенціальної енергії:
![]()
Тут
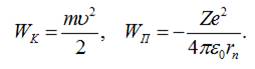
Виразимо
кінетичну енергію електрона через параметри атома.
З
того, що відцентрова сила, яка діє на електрон у атомі, чисельно
рівна силі Кулона, одержимо:
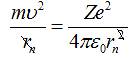 ,
,
або
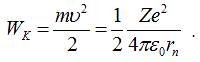
Отже, повна енергія електрона у атомі матиме
вигляд:
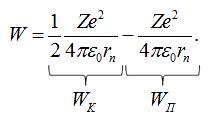
З останнього
рівняння легко бачити, що
![]()
Отже, повна енергія
електрона в атоміна
орбіті радіусом ![]() :
:
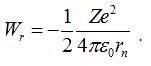
Підставивши
вираз для радіуса орбіти у попередню
формулу одержимо повну енергію електрона (атома) в n-ному енергетичному стані:
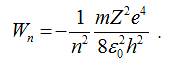
§5.
Дослід Д. Франка і Г. Герца (1913 р.)
Експериментальне
доведення існування
стаціонарних
станів атомів (електронів)
V.І. Мета експерименту:вивчити
поведінку атомів при передачі їм наперед визначених порцій енергії.
1. Якщо
стаціонарних станів у атома немає (внутрішня енергія атома може
приймати довільні значення), то передаючи атому довільну кількість енергії,
атом збуджується і його енергія зростає;
2.Якщо стаціонарні стани є, то, для збільшення енергії атома, йому
необхідно надати енергію, значення якої перевищує різницю енергій між сусідніми
стаціонарними станами.
При передачі меншої енергії, атом не перейде на вищий
енергетичний рівень, лише збільшиться його кінетична енергія.
V. ІІ. Схема експерименту
1. Енергію атомам
передають, бомбардуючи їх електронами, прискореними електричним полем.
2. 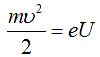 – кінетична енергія, яку набуває електрон, пройшовши
різницю потенціалів U.
– кінетична енергія, яку набуває електрон, пройшовши
різницю потенціалів U.
3. Скляна посудина
заповнена парою ртуті при низькому тиску (рис. 1. 7).
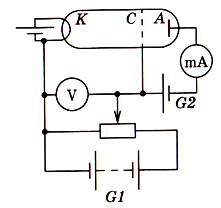
Рис. 1. 7
4. Батарея G1 створює прискорююче
електричне поле.
5. Напругу U між
катодом K і сіткою C
можна регулювати потенціометром.
6. Між сіткою і анодом
батарея G2 створює слабке затримуюче
поле з напругою біля 0,5 В, яке перешкоджає попаданню на анод повільних електронів.
V. ІІІ. Результати експерименту
1.
При напрузі до 4,9 В:
Ø
внутрішня енергія атомів
не змінюється;
Ø
пружні
зіткнення прискорених електронів з атомами;
Ø електрони, прискорені
електричним полем між катодом и сіткою, перемагають затримуюче поле і досягають
анода;
Ø число електронів, які
досягнули анода за одиницю часу, росте пропорційно
напрузі.
2.
При напрузі вищій за 4,9 В:
Ø непружні
зіткнення електронів з атомами;
Ø стрибкоподібне
збільшення внутрішньої енергії атома та майже повна втрата кінетичної енергії
електрона після співудару;
Ø
гальмівне
поле недопускає повільні
електрони до анода, і сила струму різко спадає (рис. 1.8);
Ø струм
не падає до нуля, бо деяка доля електронів попадає на сітку без
взаємодії з атомами.
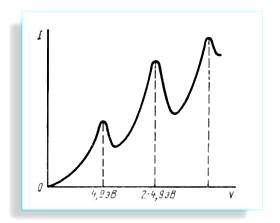
Рис. 1. 8
V. ІV. Висновки з експерименту
1. Внутрішня
енергія атома ртуті може змінюватися на величину, не меншу, ніж заΔE=4,9 еВ.
2.
Збуджені при напрузі 4,9 В атоми
ртуті переходять на нижчі енергетичні рівні, випромінюючи при цьому кванти
енергії, пара ртуті начинає світитися з частотою
випромінювання:
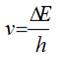 .
.
3) Виходячи
з попереднього: в атомі існує набір дискретних стаціонарних енергетичних станів.