7.7.
Механізм електрохімічної корозії металевої поверхні
У більшості випадків корозія
являє собою електрохімічний процес. На поверхні металу утворюються
електрохімічні комірки, в яких різні ділянки діють як області окиснення та
області відновлення.
Нижче наведені дві
напівреакції окисно-відновного
процесу іржавіння:
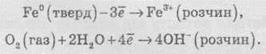
Сумарне рівняння реакції
корозії заліза можна записати так:
![]()
Схематично процеси, які відбуваються на поверхні заліза або сталі при контакті
з водою, можна подати так:
Концентрація кисню, розчиненого в краплі води, визначає те, які області на поверхні металу є місцем відновлення, а які — місцем окиснення.
По краях краплі,
де концентрація розчиненого
кисню вища, кисень відновлюється до гідроксид-йонів.

Необхідні для відновлення кисню електрони переміщаються із центра краплі, де вони вивільняються при окисненні Феруму й де концентрація розчиненого кисню мала. Йони Феруму переходять
у розчин. Вивільнювані електрони по поверхні металу переміщаються до країв краплі.
Сказане вище пояснює, чому
корозія найбільшою мірою проявляється в центрі краплі води або під шаром фарби:
це області, в які надходження кисню обмежене. Тут утворюються так звані «раковини», в яких Ферум переходить у розчин.
Іржа як така виникає в результаті послідовності вторинних процесів у розчині, куди дифундують
із поверхні металу йони Феруму
та гідроксид-йони. Захисний
шар на поверхні не утворюється.
Активність протікання реакції відновлення Оксигену залежить від кислотності середовища, тому в кислому середовищі
корозія прискорюється.
Будь-які примісні солі, наприклад, натрій хлорид у бризах морської води, сприяють утворенню іржі, оскільки збільшують електропровідність води.
Можливо, проблему корозії ніколи не вдасться розв’язати повністю, і найбільше, на що можна розраховувати,— це уповільнити
її, але не зупинити.