Розділ 1. Деякі відомості про хімічний зв'язок і будову речовин
1.1. Типи зв’язків.
Ковалентний зв'язок: полярний та неполярний. Електронегативність.
Полярність молекул.
Електронна теорія будови атомів пояснила, як атоми з’єднуються в
молекули, тобто природу та механізм утворення хімічного зв’язку.
Визначення. Хімічний зв’язок
– це взаємодія двох або кількох атомів, у результаті якої утворюється хімічно
стійка двох або багатоатомна система (наприклад, молекула чи кристал).
Отже,
під час формування кристалів або молекул утворюються хімічні зв’язки, а в
процесі розпаду кристалів або молекул вони руйнуються, Утворення хімічного
зв’язку супроводжується зменшенням повної енергії системи.
В основі теорії хімічного зв’язку лежать уявлення про електронну взаємодію. Найбільш стійкими угрупуваннями електронів є завершені зовнішні електронні шари атомів інертних
елементів (двоелектронний у
гелію і восьмиелектронний у
решти інертних елементів). Незавершені зовнішні електронні шари всіх інших
елементів є нестійкими угрупуваннями електронів. Під час з’єднання атомів з незавершеними зовнішніми електронними шарами перебудовуються їх електронні оболонки – неспарені електрони різних атомів утворюють
електронні пари, які є спільними для двох чи більшої кількості
атомів або зміщуються до одного атома. Відомі
такі типи хімічного зв’язку: ковалентний, йонний, водневий, металічний.
Ковале́́нтний зв'язо́́к — хімічний зв'язок, характерною особли-вістю якого є те, що задіяні атоми ділять між собою одну чи
більше спільних пар електронів, які і спричиняють їх взаємне притягування, що утримує їх у молекулі. Електрони при цьому, як правило, заповнюють
зовнішні електронні оболонки задіяних атомів.
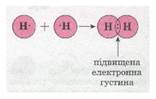
Для прикладу розглянемо утворення
молекули водню Н2. Відомо, що
кожний атом Гідрогену має в електронній оболонці один s-електрон, а завершеним для нього буде двохелектронний рівень, подібний завершеному рівню атома Гелію. Уразі зближення двох атомів Гідрогену
за рахунок сил притягання, що діють між
їхніми ядрами та електронами,
s-електронні хмари сферичної
форми обох атомів частково перекриваються. У місці перекривання виникає підвищена електронна густина, яка притягує до себе
ядра обох атомів і забезпечує міцність їхнього сполучення в молекулу.Якщо неспарений
валентний електрон позначити точкою, а спільну електронну пару — двома точками,
то можна записати схему утворення хімічного зв'язку між атомами Гідрогену в молекулі водню:
Мал.1. Схема утворення хімічного зв'язку між атомами.
Якщо позначити спільну
електронну пару рискою, то запис називають структурною
формулою водню Н—Н. Розглянемо
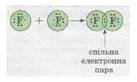
ще один приклад утворення
ковалентного зв'язку в молекулі
фтору F2. Кожний атом Флуору
(елемент VII групи) має 7 валентних електронів, з них — один р-електрон неспарений:Уразі зближення двох атомів Флуору відбувається
перекривання хмар двох неспарених р-електронів, утворюється спільна електронна пара:
Мал.2. Електронна пара.
У наведеному прикладі зовнішній енергетичний рівень завершується до
октету — восьми електронів.
Хімічний зв'язок, який утворюється
за допомогою спільних електронних пар, називають ковалентним зв'язком.
Слово «ковалентний» означає «спільновалентний»: атоми разом володіють усуспільненими валентними електронами. У розглянутих випадках спільна електронна пара належить обом атомам однаковою мірою. Такий ковалентний
зв'язок називають неполярним. Він виникає під час взаємодії атомів неметалів одного й того самого хімічного
елемента, оскільки в них однакова електронегативність.
Так, у молекулах Н2, О2, F2, Сl2 існує неполярний ковалентний зв'язок.
Кратність ковалентного зв'язку. Бувають випадки, коли два атоми усуспільнюють кілька пар валентних електронів. У такому разі говорять про кратність
ковалентного зв'язку. Якщо між атомами виникла одна спільна електронна пара, то такий ковалентний зв'язок називають одинарним, якщо дві — подвійним, якщо три — потрійним.
Ковалентний полярний
зв'язок. Якщо
атоми, що взаємодіють, мають різну електронегативність (атоми різних неметалів), то
спільна електронна пара зміщується до атома з більшою електронегативністю.
У цьому разі виникає полярний
ковалентний зв'язок. Наприклад, у молекулі фтороводню HF зв'язок ковалентний полярний:
Мал.3.Полярнийковалентнийзв'язок.
У результаті зміщення електронної
пари в молекулі HF (стрілка показує напрямок
зміщення) молекула стає полярною, виникає диполь.
Диполь — це система з двох зарядів, однакових за величиною і протилежних зазнаком. Вважають, що атом, до якого зміщена електронна
пара, набуває деякого
негативного заряду, а атом, від якого
зміщена електронна пара, — деякого позитивного заряду:
![]()
(гр. літера δ (дельта) позначає
частковий заряд, тобто менший за одиничний).Полярний ковалентний
зв'язок незавжди зумовлює утворення диполя. Наприклад, у разі формування молекули карбон(ІV)
оксиду С02 електронні пари зміщуються до Оксигену як
до більш електронегативного
елемента. Але диполь не виникає,
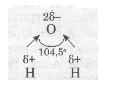
бо молекула симетрична.Молекули води Н2О, навпаки, мають кутову будову. Полярні зв'язки О—Н розміщені під кутом 104,5°, що спричинює несиметричність
структури і полярність
молекул води:
Бувають
випадки, коли кількість хімічних зв'язків, утворених
атомом у сполуці, більша за кількість неспарених електронів на зовнішньому
енергетичному рівні атома. Так, у атомі Карбону на зовнішньому рівні всього два неспарені електрони, але номер групи, в якій він
розміщений, засвідчує, що в атомі має
бути 4 валентні електрони. Звідки ж беруться ще два неспарені електрони? Згадаємо електронну формулу Карбону:
6С 1s22s22p2. Додаткові два неспарені електрони з'являються в результаті розпаровування 2S-електронної пари, яке відбувається
безпосередньо в процесі взаємодії атомів Карбону з іншими атомами. При цьому атом переходить з
основного стану у збуджений: 6С 1s22s12p3
Електронегативність. Визначення. Здатність атома хімічного елемента притягувати досебе спільні електронні пари називається електронегативністю. Позначення: ЕН.
Електронегативність елемента визначається
сумою його енергій йонізації та спорідненості до електрона.
Чим більше електронегативність
атома, тим сильніше він притягує спільну
електронну пару. Під час утворення ковалентного зв’язку спільні електронні пари зміщуються в бік більш електронегативного атома –
хлору у молекулі НС1, оксигену в молекулі Н₂О, нітрогену в молекулі NН₃ тощо. Внаслідок цього зв’язки поляризуються:
на атомі з вищою електронегативністю (СІ, O, Н) виникає від’ємний заряд (—q), а на атомі з нижчою (Н) — позитивний (+q). Такі заряди атомів у молекулі називаються ефективними. Експериментально встановлено, що в молекулі НС1
q (СІ) = - 0,18; q (Н) = + 0,18.
Електронегативність елемента та періодичний закон.
Електронегативність підлягає періодичному закону. У періоді електронегативність елементів зростає із збільшенням порядкового
номера елемента, тобто зліва направо. На початку періоду містяться елементи, електронегативність яких низька (метали), а в кінці – найбільш електронегативні (неметали). В групі електронегативність елементів зменшується із зростанням порядкового
номера, тобто згори донизу.
Найбільш електронегативним
у періодичній системі є
фтор. Інертні елементи електронегативності не мають.
За зростанням електронегативності хімічні елементи можна розташувати в такій послідовності:
Rb, К, Nа, Li, Sr, Са, Mg, Be, Al, Sn, Ga,
Sb, Si,В,Аs, Н, Те, Р, С, Sе, І, S, Вr, Сl, N. O, F
Межізастосовності.Електронегативністьзастосовуютьякякіснухарактеристикудлявизначеннянапрямкузміщенняспільнихелектроннихпарпідчасутвореннямолекул, тобтодляоцінкиполярностіхімічногозв’язкуврізнихсполукахіпоясненняїххімічноїповедінки. Чимбільшоюєрізницяелектронегативностейатомів, щоз’єднані, тимполярнішийзв’язокміжними.
Дляоцінкиполярностізв’язкузробиморозрахунокрізницьелектронегативностейпарелементівугідратахоксидівнатрію, хлору, алюмінію.
Відомо, що уразі формальної подібності формул гідроксиду натрію (NаОН) та гіпохлоритної кислоти (НОСІ) з загальною
формулою ЕОН ці речовини мають протилежні властивості: основні (NаОН) і кислотні (НОСІ). Гідроксид алюмінію А1(ОН)₃ є амфотерною сполукою, тобто залежно від умов може виявляти основні чи кислотні
властивості. Розглянемо причину
такої поведінки.
У гідроксиді натрію різниця між електронегативностями
оксигену та натрію становить 3,5 – 0,93 = 2,57, оксигену та гідрогену – 3,5 – 2,1 =
1,4. Зв’язок Nа–О значно полярніший за Н–O (2,57 > 1,4). Гідроксид натрію є йонною сполукою, асоціатом йонів натрію і ОН-. Оскільки більш полярний зв’язок розривається легше, зрозуміло, чому NаОН виявляє основні властивості. Рівняння дисоціації у водному розчині або в розплаві:
![]()
Угіпохлоритнійкислотірізницяміжелектронегативностямиоксигенутагідрогену дорівнює 3,5 – 2,1 = 1,4, оксигенутахлору – 3,5 – 3,0= 0,5. Такимчином, гіпохлоритнакислота – речовиназковалентнимиполярнимизв’язками. Оскількизв’язокН–Ополярнішийзазв’язокО–Сl (1,4 >
0,5), водномурозчинівідбуваєтьсярозривсамецьогозв’язку, анеО–Сl, іНОСl виявляєкислотнівластивості. Рівняння дисоціації:
![]()
Полярпість.Полярністьмолекулзалежитьвідполярностіокремихзв’язківіїхположеннявмолекулі, тобтовідбудовимолекул.
Молекули простих речовин (![]() ,
, ![]() ,
, ![]() ,
, ![]() ), утворені неполярними ковалентними зв’язками, неполярні. Молекули складних речовин можуть бути полярними та неполярними. До речовин з неполярними молекулами належать: діоксид вуглецю
), утворені неполярними ковалентними зв’язками, неполярні. Молекули складних речовин можуть бути полярними та неполярними. До речовин з неполярними молекулами належать: діоксид вуглецю ![]() , метан
, метан ![]() , бензол
, бензол![]() , диметиловий етер
, диметиловий етер ![]() О тощо, до речовин з полярними молекулами – діоксид сірки
О тощо, до речовин з полярними молекулами – діоксид сірки ![]() , вода
, вода ![]() O, аміак
O, аміак ![]() , етиловий спирт
, етиловий спирт ![]() OН тощо.
OН тощо.
У неполярних молекулах "центри тяжіння" електронної хмари та позитивних зарядів ядер збігаються, а у полярних – ні. Тому полярні молекули можна розглядати як електричні диполі, де заряди, різні за знаком (+q і -q), але однакові за значенням, знаходяться на певній відстані один від одного. Мірою полярності молекул є електричний момент диполя.
Електричний момент диполя. Це фізична величина, що визначається добутком заряду д і відстані І між центрами позитивного та негативного зарядів
у молекулі. Позначення: р (вимова: пе), визначальне
рівняння: р = ql, одиниця вимріювання: Кл • м
(кулон на метр). Електричний момент диполя в молекулі залежить від її будови.
За наявністю чи відсутністю електричного моменту
диполя можна робити висновки щодо геометричної
будови молекули. Так,
молекула ![]() неполярна, хоча зв’язки С=O – полярні, тому що вона має лінійну будову
(O=С=O). Молекули
неполярна, хоча зв’язки С=O – полярні, тому що вона має лінійну будову
(O=С=O). Молекули![]() та
та ![]() О мають
електричний момент диполя, оскільки будова їх є кутовою.
О мають
електричний момент диполя, оскільки будова їх є кутовою.
Фізичні властивості молекулярних сполук з ковалентними зв’язками. Молекулярні сполуки з ковалентними зв’язками за звичайних умов можуть мати різний
агрегатний стан: твердий
(йод ![]() , сахароза
, сахароза ![]() тощо), рідкий (бром
тощо), рідкий (бром![]() , вода
, вода ![]() O, етанол
O, етанол ![]() ОН тощо),
газоподібний (хлор
ОН тощо),
газоподібний (хлор ![]() , кисень
, кисень![]() , амоніак
, амоніак ![]() , диметиловий
етер (
, диметиловий
етер (![]() О тощо).
Температури кипіння та плавлення цих молекулярних сполук низькі (порівняно зі
сполуками з йонним та металічним зв’язком).
О тощо).
Температури кипіння та плавлення цих молекулярних сполук низькі (порівняно зі
сполуками з йонним та металічним зв’язком).
Тому молекулярні сполуки,
як правило, леткі. Речовини,
молекули яких полярні, мають виші температури кипіння та плавлення, ніж речовини з неполярними молекулами. Вони розчиняються
в полярних розчинниках, наприклад у воді. Це пояснюється взаємним притяганням полярних молекул. Речовини, молекули яких неполярні,
як правило, розчиняються в неполярних
розчинниках (бензині, чотирихлористому вуглеці), але можуть розчинятися і в полярних розчинниках. Так, йод не
розчиняється у воді, але розчиняється в ![]() і спиртах.
і спиртах.