5.3.
Властивості кислот, основ та солей з точки зору електролітичної дисоціації.
Як відомо, речовини, що належать до певного класу – кислоти, основи, солі та ін. мають
властивості, характерні для
цього класу.
Кислоти виявляють такі загальні властивості:
їх розчини кислі на смак, однаково змінюють колір індикаторів, взаємодіють з
основами та основними оксидами тощо.
Загальні властивості основ протилежні властивостям кислот –
вони взаємодіють з кислотами та кислотними
оксидами.
Луги – розчинні у воді основи, характеризуються
ще такими загальними властивостями: їх розчини милкі, однаково змінюють колір індикаторів, роз’їдають тваринні та рослинні тканини.
Теорія електролітичної дисоціації пояснює ці явища певним
характером електролітичної дисоціації
– кислотним (з утворенням катйонів ![]() ) чи основним (з утворенням анйонів
) чи основним (з утворенням анйонів ![]() ). Тому з точки зору цієї теорії можна
запропонувати такі визначення кислот, основ та солей.
). Тому з точки зору цієї теорії можна
запропонувати такі визначення кислот, основ та солей.
Кислоти – це електроліти, які під час дисоціації утворюють катйони Гідрогену (інших катйонів не утворюють):
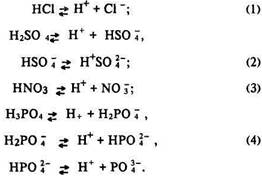
Гідроген-йони у водних розчинах гідратовані. Вони існують у вигляді гідроксоній-йонів Н₃![]() . Але для спрощення їх записують як
. Але для спрощення їх записують як ![]() .
.
Загальні властивості розчинів кислот обумовлені саме катйонами Гідрогену![]() . Концентрація цих йонів – кількісна міра
кислотності середовища.
. Концентрація цих йонів – кількісна міра
кислотності середовища.
Основи – це електроліти, які під час дисоціації утворюють анйони гідроксид-йона ![]() (інших
анйонів не утворюють):
(інших
анйонів не утворюють):
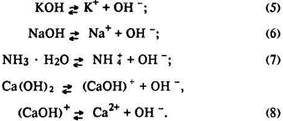
Загальнівластивостіоснов, зокремарозчинівлугів, обумовленігідроксид-йонами![]() . їхконцентрація – кількіснаміралужностісередовища.
. їхконцентрація – кількіснаміралужностісередовища.
Солі – це електроліти, які під час дисоціації утворюють катйони залишку основи та йони кислотного залишку:![]()
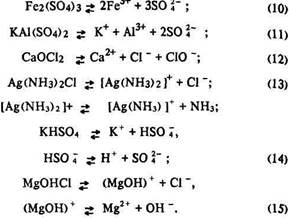
Розчини середніх солей не мають однакових для них йонів, тому не виявляють загальних властивостей, як розчини кислот або лугів.
Теорія електролітичної дисоціації пояснює також кислотний характер дисоціації кисневмісних кислот та
спиртів (з відщепленням йонів Гідрогену![]() а не
а не ![]() ); основність кислот взагалі та одноосновність монокарбонових
кислот; збільшення сили
кислот з підвищенням числа атомів
Оксигену, зв’язаних з атомом неметалу в молекулі кислоти; деякі відмінності властивостей лугів і нерозчинних у воді основ, амфотерність, належність солей до сильних електролітів. Доведемо це.
); основність кислот взагалі та одноосновність монокарбонових
кислот; збільшення сили
кислот з підвищенням числа атомів
Оксигену, зв’язаних з атомом неметалу в молекулі кислоти; деякі відмінності властивостей лугів і нерозчинних у воді основ, амфотерність, належність солей до сильних електролітів. Доведемо це.
Електролітичної дисоціації' зазнають найбільш полярні зв’язки. У молекулах кисневмісних кислот і спиртів найполярнішими є саме зв’язки атомів водню з киснем, а не елемента з
киснем. Приклад розрахунку полярності
зв’язків наведено в п. 1.1. Тому під
час дисоціації, скажімо,
НОСl або С₂![]() ОН відщеплюються йони
ОН відщеплюються йони ![]() , а не
, а не ![]() , і сполуки виявляють властивості кислот, а не
основ:
, і сполуки виявляють властивості кислот, а не
основ:
![]()
Основність кислот визначається
числом атомів водню, зв’язаних полярними зв’язками з атомами кисню. Саме тому монокарбонові органічні кислоти, незважаючи на велике число атомів водню (більше
за одиницю), є одноосновними:
![]()
Зв’язкиатомівГідрогенузКарбономувуглеводневихрадикалахємалополярнимиідисоціаціїнепідлягають.
З появоювмолекулахкислотатомівОксигену, зв’язанихзатомомнеметалуподвійнимзв’язком, полярністьзв’язкуО–НзбільшуєтьсявнаслідокперерозподілуелектронноїгустинидоатомаОксигену. Саметомуорганічнікислотимаютьбільшвираженікислотнівластивості, ніжвідповідніспирти, аврядах H₂SО₃ – Н₂SO₄ іНСlO – НСlO₂ – НСlO₃ – НСlO₄ цівластивостіпосилюютьсязліванаправо.
Луги відрізняються від інших основ ступенем дисоціації. Луги – це сильні розчинні
електроліти, які практично повністю дисоціюють на йони. У лугах метали та гідроксид-йони
зв’язані йонним зв’язком. Зі зменшенням
радіуса атома металу, збільшенням його електронегативності та ступеня окиснення полярність зв’язку Ме–O в основі знижується, йонний характер зв’язку змінюється на ковалентний, здатність до дисоціації, а отже, сила основ послаблюється. Нерозчинні у воді основи, крім
основ f-елементів, є слабкими електролітами. Це – гідроксиди магнію, заліза (II), марганцю (II) тощо. Гідроксид амонію є слабким електролітом внаслідок наявності між йонами ![]() і ОН-
водневого зв’язку N-Н ... О.
і ОН-
водневого зв’язку N-Н ... О.
У разі близьких значень полярності зв’язків Ме–O і О–Н гідроксиди металів виявляють амфотерні властивості, тобто залежно від умов дисоціюють за кислотним або основним
типом:
![]()
Прикладом амфоліту є також вода: Н₂O⇆![]() +
+ ![]()
Середні солі (прості, змішані та подвійні) як сполуки з йонним зв’язком є сильними електролітами. Вони повністю дисоціюють на йони за одним ступенем – рівняння (9)–(12).
Багатоосновні кислоти та багатокислотні основи, кислі, основні та комплексні солі дисоціюють ступінчасто – рівняння (2), (4), (8), (13)–(15). Саме
тому в розчинах основних
солей, крім анйонів кислотних залишків, можуть міститься гідроксид-йони ![]() а в
розчинах кислих солей, крім катйонів металів, Гідроген-йони
а в
розчинах кислих солей, крім катйонів металів, Гідроген-йони ![]() – рівняння
(14), (15).
– рівняння
(14), (15).
Слід підкреслити, що в розчинах індивідуальних
речовин багатоступінчастих електролітів – дисоціація відбувається переважно за першим ступенем. Дисоціація за другим ступенем значно менша, ніж за першим, а за третім – менша, ніж за другим. Внаслідок цього розчини кислих
солей містять незначну кількість Гідроген-йонів ![]() – мають
слабкі кислотні властивості. Розчини основних солей характеризуються невеликою
кількістю гідроксид-йонів
– мають
слабкі кислотні властивості. Розчини основних солей характеризуються невеликою
кількістю гідроксид-йонів ![]() –
виявляють слабкіосновні властивості.
–
виявляють слабкіосновні властивості.
Кислі, основні та комплексні солі є сильними електролітами лише за першим ступенем дисоціації.
Для того щоб дисоціація відбувалася за подальшими ступенями, треба створити
відповідні умови: з розчинів кислот і кислих солей видалити йони водню
(шляхом введення йонів ![]() )
)
і навпаки, з розчинів основ і основних солей вивести гідроксид-йони (шляхом внесення йонів ![]() ):
):
Молекулярні рівняння:
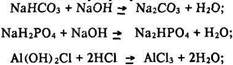
Йонні рівняння:
