3.3. Оборотність хімічних реакцій. Хімічна рівновага. Фактори, які зміщують хімічну рівновагу. Принцип Ле -Шательє.
Оборотність хімічних реакцій. Хімічні реакції бувають необоротні та оборотні. Реакції, які перебігають в одному напрямку до повної витрати однієї з реагуючих сполук, є необоротними. Реакції, що за однакових умов протікають у протилежних напрямках, – оборотні
Так, реакція між міддю та концентрованою
азотною кислотою с необоротною:
Сu + 4НNО3(конц) =Сu(NО3)2
+2NО2 +2Н2О
Ця реакція іде лише в одному напрямку.
Під час пропускання оксиду
азоту (IV) через розчин нітрату
міді (II) металічна мідь та азотна кислота не утворюються.
Взаємодія водню з йодом може бути прикладом оборотної реакції:
Н₂ + I₂ ⇆ 2НІ.
Хімічна рівновага. Розглянемо встановлення хімічної рівноваги на прикладі оборотної реакції взаємодії водню з йодом:
Н₂ + I₂ ⇆ 2НІ.
Кінетичне рівняння швидкості прямої реакції:
![]()
Кінетичнерівнянняшвидкостізворотноїреакції:
![]()
Напочаткуоборотноїреакціїшвидкістьпрямоїбільша, ніжзворотної: ![]() Далі, зізниженнямконцентраціївихіднихсполукіпідвищеннямконцентраціїпродуктуреакціїшвидкістьпрямоїреакціїзменшується, азворотної – зростає. Через деякий час швидкості прямої та зворотної реакцій стануть однаковими
Далі, зізниженнямконцентраціївихіднихсполукіпідвищеннямконцентраціїпродуктуреакціїшвидкістьпрямоїреакціїзменшується, азворотної – зростає. Через деякий час швидкості прямої та зворотної реакцій стануть однаковими ![]() , отже реакція перебуває у стані хімічної рівноваги.
, отже реакція перебуває у стані хімічної рівноваги.
Стан оборотної реакції,
у якому швидкості прямої та зворотної реакцій однакові, називається хімічною рівновагою.
Хімічна рівновага
– це динамічна рівновага (пряма та зворотна реакції не зупиняються, а протікають з однаковою швидкістю). У стані рівноваги число молекул НІ, що утворюються і розкладаються за одиницю часу, однакове.
Рівноважні концентрації. Концентрації компонентів реакції в стані рівноваги називаються рівноважними. Рівноважні концентрації за умов даної рівноваги незмінні. Вони позначаються квадратними дужками [ ]. Тоді кінетичне рівняння швидкості прямої реакції в стані рівноваги має вигляд![]() зворотної –
зворотної – ![]()
Константа рівноваги. Стан хімічної рівноваги
характеризується константою рівноваги.
Константа рівноваги К - це відношення констант швидкостей прямої та зворотної реакцій:К = ![]() /
/![]() .
.
У розглянутій оборотній реакції

У загальному вигляді оборотна реакція описується рівнянням
![]()
Визначальне рівняння константи рівноваги:
![]()
Константа рівноваги залежить від температури
та природи реагуючих речовин, але не залежить від концентрації компонентів реакції (порівняйте з константами швидкості
реакцій). Числове значення константи рівноваги характеризує вихід реакції. При К>> 1 вихід
реакції великий, при К < 1 – малий.
Зміщення хімічної рівноваги. За постійних зовнішніх умов (незмінних
температур, тиску, концентрації
реагентів) рівновага оборотної реакції може зберігатися дуже довго. Вона порушується, якщо змінюється температура, концентрація
реагентів, тиск (для деяких газоподібних систем), тому
що швидкості прямої та зворотної реакцій стають нерівними. Через деякий час швидкості прямої та зворотної реакцій знову набувають однакових значень. Встановлюється нова рівновага,
при якій рівноважні концентрації реагентів будуть іншими.
У 1884 р. французький вчений Ле Шательє
(1850 – 1936) виявив закономірність
впливу зовнішніх умов на рівновагу оборотних хімічних реакцій – принцип зміщення рівноваги (принцип Ле Шательє). Принцип формулюється так: якщо умови, за яких система знаходиться в рівновазі, змінити, рівновага зміщується в напрямку процесів, які протидіють
цій зміні
Розглянемо зміщення хімічної рівноваги за
змін концентрації реагуючих сполук, температури та
тиску на прикладі реакції синтезу аміаку з азоту та водню:
![]()
Вплив концентрації. У разі збільшення концентрації азоту або водню рівновага буде
зміщуватися у бік зменшення цих концентрацій, тобто в напрямку утворення
аміаку.
Вплив температури. З термохімічного рівняння зворотної реакції
синтезу аміаку з азоту та водню видно, що пряма реакція екзотермічна, а
зворотна (розклад аміаку) – ендотермічна. Тому при збільшенні температури
рівновага буде зміщуватися в бік зворотної (ендотермічної) реакції, яка протидіє
підвищенню температури. У разі зниження температури рівновага буде зміщуватися
в бік прямої (екзотермічної) реакції, яка протидіє охолодженню.
Отже, під час підвищення температури рівноважної системи рівновага
зміщується в бік ендотермічної реакції, а під час зниження – в бік
екзотермічної.
У реакціях, які протікають без теплових ефектів, зміна температури не викликає зміщення рівноваги. У цьому випадку підвищення температури призводить лише до більш швидкого
встановлення рівноваги.
Вплив тиску. Зміна тиску зміщує
рівновагу системи, якщо реакція йде
між газами і при цьому змінюються об’єми газоподібних речовин. Наприклад, пряма реакція синтезу аміаку (N₂ + ЗН₂ → NH₃) протікає зі зменшенням об’єму
газоподібних речовин (тобто в замкненому реакторі тиск теж
знижується), а зворотна (2NH₃ → N₂ + ЗН₂) – зі збільшенням їх об’єму, а отже, з підвищенням тиску в замкненому реакторі. Тому зростання тиску зміщує рівновагу в бік прямої реакції
і протидіє перебігу зворотної реакції.
Підвищення тиску зміщує рівновагу системи в бік утворення
менших об’ємів, а зменшення – в бік утворення більших об’ємів. Якщо в процесі оборотної реакції об’єми газоподібних речовин не змінюються, то зміна тиску не впливає на стан рівноваги системи. Наприклад, у реакції: Н₂ + І₂ ⇆ 2НІ під дієютиску рівновага не зміщується.
Вплив каталізатора. Каталізатори не зміщують
хімічну рівновагу, тому що вони однаково впливають на швидкість прямої та зворотної реакцій. За наявності каталізаторів рівновага встановлюється швидше.
Завдяки застосуванню принципу Ле Шательє до оборотних
реакцій можна керувати хімічними процесами.
Приклади розв’язання задач
Задача 1.Як впливатиме підвищення
тиску на хімічну рівновагу в оборотній системі
Fe3O4 (т) + СО
(г) ⇆ 3FeO (т) + СО2 (г) ?
Розв’язання. Запишемо вирази для швидкостей прямої (vпр) і зворотної
(vзвор) реакцій:
vпp = kпр [СО]; vзвор = kзвор [СО2].
Швидкості прямої і зворотної реакцій не залежать від концентрацій твердих речовин. За підвищення тиску в два рази в таке саме число разів збільшуються концентрації СО і СО2. Отже,
швидкості прямої і зворотної реакцій збільшаться в однакове число разів, і рівновага в системі не зміститься.
Задача 2. Як зміниться швидкість реакції, температурний коефіцієнт якої 2, за підвищення температури з 10
до 40 °С?
Розв’язання
З формули
![]()
можна вирахувати, у скільки разів зміниться
швидкість реакції:
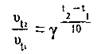
Підставимо значення
в цю формулу і проведемо обчислення:
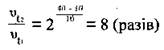
Відповідь: швидкість
реакції збільшиться у 8 разів.
Задача 3. Як зміниться швидкість прямої реакції ![]() якщо
об’єм газової суміші зменшити у 3 рази?
якщо
об’єм газової суміші зменшити у 3 рази?
Дано:
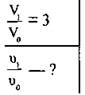
Розв’язання
1. Якщо допустити, що початкові концентрації
азоту і водню (с0) відповідно
становлять а моль/л і b моль/л, то кінетичне рівняння для визначення швидкості прямої реакції буде таким:
![]()
2. Зменшення об’єму газової суміші в 3 рази приведе до підвищення концентрації реагентів також у 3 рази: c1(N2) = 3а
моль/л, а с1(Н2) = 3b моль/л. Кінетичне рівняння:
![]()
3. Для
того щоб розрахувати, у скільки разів швидкість
прямої реакції змінилась, поділимо вираз для швидкості після зменшення об’єму суміші (II) на вираз для початкової швидкості (І):
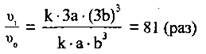
Відповідь: швидкість
прямої реакції збільшиться у 81 раз.
Задача 4. Як зміниться швидкість прямої реакції ![]() якщо
тиск у системі підвищити в 3 рази?
якщо
тиск у системі підвищити в 3 рази?
Дано:
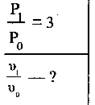 Розв’язання
Розв’язання
1. Допустимо, що початкові концентрації SO2 і O2 становлять відповідно а моль/л
і b моль/л. Тоді кінетичне
рівняння для визначення швидкості прямої реакції становитиме:
![]()
2. Підвищення тиску в 3 рази приведе до підвищення концентрації регентів у стільки ж разів: С1(SO2) = 3а
моль/л, а С1(O2) = 3b моль/л. Кінетичне рівняння:
![]()
3. Для
того щоб розрахувати, у скільки разів швидкість
прямої реакції змінилась, поділимо вираз для швидкості після підвищення тиску суміші (II) на вираз для початкової швидкості (І):
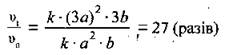
Відповідь: швидкість
прямої реакції збільшиться у 27 разів.
Задача 5. У системі СО(г) + Сl2(г) =
СОСl2(г) рівноважні концентрації речовин [Сl2]p = 0,3 моль/л,
[СО]p = 0,2 моль/л, [СОСl2]p = 1,2
моль/л. Обчислити константу рівноваги
і початкові концентрації Сl2 і
CO.
Розв'язання: Константа рівноваги:
![]()
Оскільки за рівнянням реакції з
1 моль CO або СІ2 утворюється
1 моль СОСІ2, то [СО]о = 1,2 + 0,2 = 1,4 моль/л; а
[СІ2]o = 1,2 + 0,3 = 1,5
моль/л.
Питання
для самоконтролю:
1. Наведіть конкретні приклади
оборотних та необоротних реакцій.
2. На конкретних прикладах поясніть, від чого
залежить швидкість гомогенних
та гетерогенних реакцій.
3. Як пояснити, що каталізатори дають можливість проводити деякі реакції при нижчій температурі?
4. Схарактеризуйте основні фактори,
що впливають на швидкість хімічної реакції.