2.2. Тепловий ефект хімічної реакції.
Під
час хімічних реакцій одні хімічні зв’язки розриваються, інші утворюються.
Утворення хімічних зв’язків супроводжується виділенням певної кількості
енергії, розрив – поглинанням. Залежно від співвідношення цих величин в результаті реакції виділяється або
поглинається енергія.
Енергія, яка виділяється або поглинається під час хімічних реакцій,
називається хімічною енергією. Хімічна енергія може перетворюватися на
теплову, променеву, механічну або електричну і навпаки.
Визначення. Кількість енергії, що
виділяється або поглинається під час хімічної реакції, називається тепловим
ефектом реакції. Позначення: ![]() Н
(вимова дельта аш).
Н
(вимова дельта аш).
Тепловий ефект реакції визначають щодо 1 моля однієї
з реагуючих речовин за стандартних умов: температура 25°С (або298,15 К) і тиск
101 325 Па (або 101,3 кПа). Одиниця вимірювання теплового ефекту — кДж · моль
.
Тепловий ефект реакції — це молярна величина. Він
обумовлений різницею енергій хімічних зв’язків, які розриваються і
утворюються. Тому він може бути додатним (теплота виділяється) або від’ємним
(теплота поглинається). Залежно від знаку ефекту реакції поділяють на
екзотермічні та ендотермічні.
Екзотермічні реакції. Реакції, які
супроводжуються виділенням енергії, називаються екзотермічними. У рівняннях
екзотермічних реакцій тепловий ефект позначається зі знаком плюс:
![]() +
+ ![]() ⇆
⇆![]() + 96 кДж;
+ 96 кДж;
![]() +
+ ![]() = S
= S![]() + 297 кДж.
+ 297 кДж.
Ендотермічніреакції.Реакції, якісупроводжуютьсяпоглинанняменергії, називаютьсяендотермічними. У рівняннях ендотермічних реакцій тепловий ефект позначається зі знаком мінус:
![]() +
+ ![]() ⇆
⇆![]() – 181 кДж,
– 181 кДж,
3![]() ⇆ 2
⇆ 2![]() 289 кДж,
289 кДж,
О₂ ⇆![]() – 96,3
кДж.
– 96,3
кДж.
Визначення теплових ефектів реакції є предметом хімічної
науки — термохімії. Рівняння, в яких визначено тепловий ефект реакції,
називаються термохімічними. У цих рівняннях вказують агрегатний стан речовин
(твердий – т, газоподібний – г, рідкий –р).
Розрахунки за термохімічними рівняннями. У
розрахунках за термохімічними рівняннями слід пам’ятати, що кількість теплоти,
яка вказана в цьому рівнянні, відповідає його стехіометрії. Тепловий ефект
відповідає 1 молю реагуючої речовини.
Приклад І. Рівняння горіння сірки в кисні: Sт+ ![]() ⇆S
⇆S![]() + 297 кДж.
Визначимо масу сірки та об’єм кисню за нормальних умов, якщо під час їх
взаємодії виділилося 594 кДж теплоти. Дано: Sт +
+ 297 кДж.
Визначимо масу сірки та об’єм кисню за нормальних умов, якщо під час їх
взаємодії виділилося 594 кДж теплоти. Дано: Sт + ![]() → S
→ S![]() + 297 кДж.
+ 297 кДж.![]() = 59,4кДж. m(S) — ? V(O₂) – ?
= 59,4кДж. m(S) — ? V(O₂) – ?
Розв’язання:
Згіднозрівняннямреакції 297 кДжвідповідає 1 моль S та 1 мольО₂, 59,4 кДж - ![]() ,
,
![]() =
=  = 0,2 моль
= 0,2 моль
1) m(S)= ![]() · М = 0,2 мoть · 32 ·
· М = 0,2 мoть · 32 · ![]() кг ·
кг · ![]() = 6,4 ·
= 6,4 · ![]() кг;
кг;
2) ![]() (О₂) =
(О₂) = ![]() =0,2 моль; V(
=0,2 моль; V(![]() ) = 22,4 ·
) = 22,4 · ![]() ·
· ![]() ×
0,2 моль - 4,48 ·
×
0,2 моль - 4,48 · ![]() .
.
Відповідь: маса сірки — 6,4 · ![]() кг, об’єм кисню — 4,48 ·
кг, об’єм кисню — 4,48 · ![]() .
.
Приклад 2. За термохімічним рівнянням згоряння водню в кисні
![]() +
+ ![]() → 2Н₂
→ 2Н₂![]() + 571 кДж
розрахуємо тепловий ефект згоряння водню,
+ 571 кДж
розрахуємо тепловий ефект згоряння водню,
Дано: ![]() +
+ ![]() = 2Н₂
= 2Н₂![]() + 571 кДж.
+ 571 кДж.
![]() Н — ?
Н — ?
Розв’язання: 2 моль Н₂ — 571 кДж; 1 моль Н₂ — ![]() Н; Н = 571
кДж/2 = 285,5 кДж.
Н; Н = 571
кДж/2 = 285,5 кДж.
Відповідь: тепловий ефект згоряння водню в кисні
дорівнює 285, 5 кДж.
Приклад 3. За наведеним термохімічним рівнянням
згоряння водню в кисні розрахуємо кількість теплоти, що виділяється під час
згоряння водню об’ємом 13,44 л (за нормальних умов) і під час утворення води
об’ємом 1 л.
Дано: ![]() +
+ ![]() ⇆ 2Н₂
⇆ 2Н₂![]() + 571 кДж;
+ 571 кДж;
![]() =13,44 л.
=13,44 л. ![]() = 1 л. 𝒬 — ?
= 1 л. 𝒬 — ?
Формули: ![]() =V /
=V /![]() ;
; ![]() = 22,4 л 3
·
= 22,4 л 3
· ![]() ;
; ![]() = 18 ·
= 18 · ![]() л ·
л · ![]() .
.
Розв’язання:
1) ![]() (Н₂) =
(Н₂) =  = 0,6
моль;
= 0,6
моль;
2) згідно з
рівнянням реакції
2 моль Н₂ – 571 кДж;
0,6 моль — х;
x = 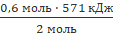 = 171,3
кДж;
= 171,3
кДж;
3) ![]() (Н₂О) =
(Н₂О) = 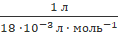 =
= ![]() =55,55
моль;
=55,55
моль;
4) згідно з рівнянням
реакції
2 моль Н₂О → 571 кДж.
55,55 моль – х;
x = 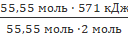 = 15860 кДж
= 15860 кДж
Відповідь: під час згоряння водню об’ємом 13,44 л виділяється 171,3 кДж теплоти;
під час утворення води об’ємом 1 л виділяється 15 860 кДж теплоти.
Питання для самоконтролю:
1. Схарактеризуйте відомі вам типи хімічних реакцій за їх
основними ознаками. Наведіть приклади.
2. На конкретних прикладах поясніть, що означає поняття
«тепловий ефект реакції».
3. Який процес називається окисненням, а який –
відновленням?