Нітрогеновмісні органічні сполуки
Органічні сполуки,
молекули яких містять атоми нітрогену, називаються нітрогеновмісними. Вони широко розповсюджені у природі і за
своїм значенням посідають особливе місце серед інших органічних сполук.
![]()
![]()
![]()
![]()
![]() Нітрогеновмісні органічні сполуки
Нітрогеновмісні органічні сполуки
Нітросполуки Аміни
Амінокислоти
Білки Нуклеїнові кислоти
1. Нітросполуки.
Нітросполуками називаються речовини, які містять у молекулі нітрогрупу (‑NO2), Нітроген якого пов'язаний з атомом Карбону.
С6H5NO2 ‑ нітробензен
У склад молекули
органічної сполуки можуть входити одна або декілька нітрогруп. У залежності від
будови радикалу, з яким пов'язана нітрогрупа, розрізняють аліфатичні,
аліциклічні, ароматичні та гетероциклічні нітросполуки. Будова нітрогруп відрізняється
рядом особливостей, які впливають на фізичні та хімічні властивості
нітросполук.
2. Аміни.
а) склад і будова молекул;
Аміни можна
розглядати як похідні амоніаку NH3, в
молекулі якого один або кілька атомів Гідрогену заміщені на вуглеводневий радикал:
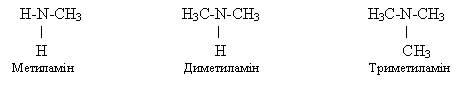
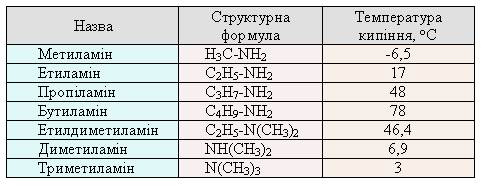
Таблиця 1
Характеристики амінів
б) класифікація;
Аміни класифікують за кількома ознаками.
‑ за кількістю атомів гідрогену, заміщених у молекулі амоніаку NH3 на
вуглеводневі залишки, аміни поділяють на первинні
(заміщений один атом гідрогену), вторинні
(два атоми) і третинні (усі три
атома):
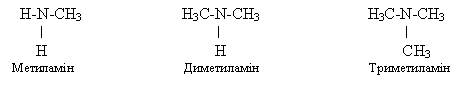
первинний амін вторинний амін третинний амін
‑ залежно від будови
вуглеводневих залишків та особливостей хімічного зв’язку в них розрізняють насичені, ненасичені, циклічні й ароматичні аміни:
в) фізичні та хімічні властивості;
Серед амінів є гази,
рідини, тверді речовини. Нижчі аміни мають запах амоніаку, розчинні у воді. Багато
амінів токсичні.
Хімічні властивості. Аміни згоряють, утворюючи
вуглекислий газ, воду та азот. Аміни, як і амоніак, виявляють основні
властивості. Проте вони сильніші основи, ніж амоніак, оскільки під впливом
вуглеводневих радикалів на атомі Нітрогену зростає електронна густина і він
міцніше утримує протони:
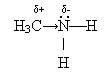
Як і амоніак, аміни діють
на індикатори, виявляючи лужні властивості. Реагують з кислотами з утворенням
солей.
Найпростіша сполука – метанамін СН3NН2.
Більш поширена назва цієї сполуки – метиламін.

г) добування та застосування.
Одним із промислових способів добування амінів ґрунтується на реакціях
спиртів з амоніаком.
Застосування. Аміни використовують у виробництві
полімерів, синтетичних волокон, барвників, лікарських препаратів.
3. Анілін.
У разі, коли аміногрупа сполучена з бензеновим ядром, утворюється
ароматичний амін – анілін або
феніламін (найпростіший ароматичний амін) ‑ С6Н5NН2.
Анілін – безбарвна оліїста речовина, малорозчинна у воді. Анілін –
токсична речовина.
За хімічними
властивостями
анілін дещо відмінний від насичених амінів. Він не змінює забарвлення індикаторів,
реагує лише з сильними кислотами:
Анілін – слабша
основа порівняно з амоніаком. Це зумовлено впливом бензенового ядра на
аміногрупу. Остання, у свою чергу, впливає на бензенове ядро. Зокрема, на
бензен не діє бромна вода, а анілін реагує з бромом, утворюючи трибромопохідну
сполуку.
Анілін має велике промислове значення, він є сировиною
для виробництва барвників, лікарських засобів, пластмас, вибухових речовин
тощо.
Основний спосіб добування
аніліну – відновлення нітробензену воднем за температури 250—350 оС та наявності каталізатора:
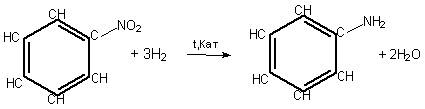
Відновлення нітробензену до аніліну відоме в історії хімії як реакція
М. М. Зініна (1842 р.).

