Тема 4. Захисні системи організму
1.
Імунітет
2.
Механізми реакції антиген – антитіло
3.
Тромбоцити
4.
Протизгортальна система крові
5.
Кровотворення і його регуляція
1.
Імунітет
Традиційно під
поняттям імунітету розуміли несприйнятливість багатоклітинного організму
(макроорганізму) до інфекційних захворювань. Ця властивість забезпечується
багатьма системами живого макроорганізму. Наприклад, шкіра, епітелій дихальних
шляхів, слизова оболонка травного каналу за їх механічної цілості є
непроникними для мікроорганізмів. Захисну функцію виконують також хімічно
активні середовища – хлоридна (соляна) кислота шлункового соку, нормальна
мікрофлора кишок. Проте головну роль у захисті макроорганізму від інфекції
відіграє система крові.
Ще в минулому
столітті було відкрито явище фагоцитозу і створено клітинну теорію
імунітету (І. Мечников). Тоді ж було виявлено протимікробні властивості
плазми крові, що дало початок гуморальній теорії імунітету (П. Ерліх).
Сучасна імунологія визнає рівноправне існування обох механізмів імунітету.
Кожен з них може бути як специфічним, так і неспецифічним.
Неспецифічний
імунітет властивий тваринам усіх рівнів розвитку і, в свою чергу,
поділяється на спадковий і клітинний (фагоцитарний). В основі спадкового
імунітету лежать загальнобіологічні явища спадковості, мінливості та
природного добору. Якщо в популяції макроорганізмів, яка потерпає від певної
інфекції, в результаті випадкової мутації з'являється індивід, білкові молекули
якого не асимілюються патогенним мікроорганізмом-агресором або є токсичними для
нього, то цей індивід чи група індивідів виживає і дає життєздатне потомство, а
решта популяції гине. Щоправда, мікроорганізми також модифікуються і
пристосовуються до нових умов, з часом захоплюючи й цей ареал, тобто процес
боротьби за виживання між макро- і патогенними мікроорганізмами відбувається
постійно. Тому є підстави вважати, що мікроорганізми та їхні молекулярні
патогенні чинники є важливими і чи не єдиними біотичними агентами, що
продовжують природний добір серед людей.
До чинників
спадкового імунітету, що розвинулись у процесі еволюції, належать протимікробні
та противірусні чинники.
Лізоцим (мурамідаза) – білок, що руйнує бактеріальні мембрани.
Він міститься в білку курячого яйця, у слині, сльозах, у складі кишкового соку,
скелетних м'язах, мозку, а також у гранулах нейтрофільних гранулоцитів. Крім
бактеріолітичної дії лізоцим стимулює також синтез антитіл.
Комплемент – термочутливий (інактивується нагріванням) комплекс з
більш ніж 20 білків, здатних до самоорганізації в систему. Більшість білків цієї
системи перебувають у плазмі крові в неактивному стані у вигляді проферментів,
які активуються в певній послідовності у разі контакту з бактеріями й вірусами.
Активація комплементу спричинює бактеріолізис, стимулює фагоцитоз, продукцію та
виділення тканинами речовин, які беруть участь у запальних процесах. В
активації комплементу бере участь білок сироватки крові пропердин, який
має виражену протибактеріальну та противірусну активність.
Інтерферон – це низькомолекулярний білок, що продукується лейкоцитами,
діє на клітини, інфіковані вірусом, не прямо, а стимулюючи вироблення
противірусних речовий сусідніми неінфікованими клітинами макроорганізму.
Катіонні білки – дефензини та гістони – виявляють високу
протибактеріальну та противірусну активність.
Більшість
зазначених чинників виробляються нейтрофільними та еозинофільними
гранулоцитами, моноцитами і діють у самій клітині, в її фагосомах або
виділяються в кров і виконують свої функції поблизу від лейкоцитів. Усі вони є
елементами системи неспецифічного спадкового гуморального імунітету.
До неспецифічного
імунітету належить також клітинний
імунітет, зумовлений активністю лейкоцитів і тромбоцитів.
Найбільшу фагоцитарну активність виявляють нейтрофільні гранулоцити і моноцити.
Зокрема, частина моноцитів, потрапляючи в тканини, перетворюється там на макрофаги.
Для цих клітин не має значення вид мікроорганізму чи природа токсину. Якщо вони
здатні знищити це чужорідне тіло, то захоплюють його і перетравлюють. Нещодавно
було відкрито різновид лімфоцитів – NK-лімфоцити (природні убивці – natural
killers), здатних за допомогою білка перфорину без попередньої
сенсибілізації знищувати пухлинні та інфіковані вірусами клітини
макроорганізму. Ці NK-лімфоцити являють собою "першу лінію оборони"
макроорганізму, оскільки вони реагують на появу чужорідних клітин негайно.
Специфічний (гуморальний,
лімфоїдний) імунітет, властивий лише хребетним тваринам,
здійснюється лімфоцитами. Лімфоцити, що виходять у кров із кісткового мозку,
імунологічно є нейтральними, або нульовими. Імунокомпетентними вони
стають після дозрівання або диференціації в органах лімфоїдної системи (Рис. 1).
Частина нульових
лімфоцитів з кров'ю потрапляє до загруднинної залози – тимуса
і внаслідок складної диференціації перетворюється на імунокомпетентні Т-лімфоцити,
тобто такі, що здатні вступати в реакцію з антигеном (бактеріями,
чужорідним білком тощо). Вперше зустрівши певний антиген, Т-лімфоцит
"запам'ятовує" його і починає ділитись (проліферувати). Більша
частина новоутворених Т-лімфоцитів вступає в реакцію з антигеном і за допомогою
перфорину знищує його. Це Т-лімфоцити-кілери (вбивці). Частина
Т-лімфоцитів у реакцію не вступає і продовжує циркулювати з кров'ю, іноді все
життя. Це лімфоцити імунологічної пам'яті. У разі повторного контакту їх
з таким самим антигеном вони "впізнають" його, починають інтенсивно
ділитись, утворюючи велику кількість Т-лімфоцитів-убивць, які й знищують
антиген. Такого типу реакцію називають вторинною імунною відповіддю, і
її перебіг значно інтенсивніший, ніж під час першої зустрічі з антигеном (первинна
відповідь).
Рисунок 1
Специфічний імунітет
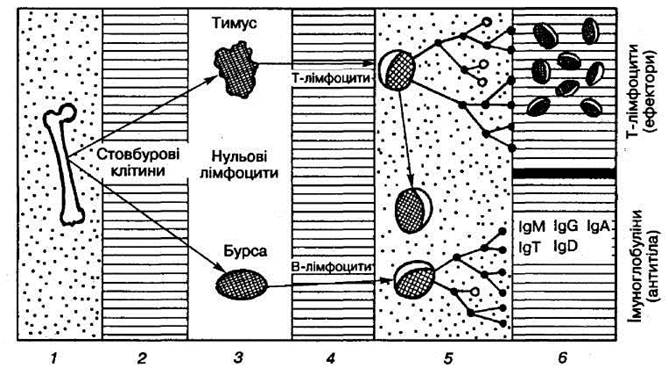
1– кістковий мозок;
2, 4, 5, 6 – кров; 3 – центральні лімфоїдні органи
Частина клітин
імунологічної пам'яті продовжує циркулювати в організмі до наступного контакту
з антигеном. Зрозуміло, що різні Т-лімфоцити "запам'ятовують" і
налаштовуються на реакцію з різними антигенами, але кожний лімфоцит розпізнає
лише один антиген. У цьому і полягає специфічність такого імунітету, хоча сам
діючий чинник Т-кілерів – перфорин – є неспецифічним. Серед Т-лімфоцитів
розрізняють також Т-хелпери (помічники), без яких лімфоцити-кілери не
можуть виконувати свою функцію, лімфоцити-супресори, які пригнічують
імунні реакції, та інші.
Друга частина
нульових лімфоцитів проходить диференціацію в лімфатичних вузлах кишок,
апендикса та кістковому мозку. Вони дістали назву В-лімфоцитів, оскільки
вперше цей процес було досліджено у птахів, у яких він відбувається у сумці
(bursa) Фабриція. Новоутворені молоді лімфоцити потоком крові розносяться
до лімфоїдних утворів різних органів, де і відбувається диференціація,
внаслідок якої вони стають імунекомпетентними, але ще не є зрілими ефекторними
В-лімфоцитами. На їхній поверхні містяться вже готові молекули імуноглобуліну –
антитіла до конкретного антигену. При першому контакті В-лімфоцита з антигеном
здійснюється "запам'ятовування" антигену і проліферація В-лімфоцитів.
Більша частина дочірніх клітин осідає в центрах розмноження в лімфоїдній
системі організму і перетворюється на плазматичні клітини, що продукують
антитіла, – виникає первинна гуморальна імунна відповідь.
Решта В-лімфоцитів
знову виходять у кров і стають лімфоцитами імунологічної пам'яті. У разі появи
антигену В-лімфоцити починають синтезувати антитіла до того антигену, що
спровокував цю імунну реакцію, які, пройшовши крізь їхню мембрану, переходять у
тканинну рідину та кров. І вже за межами В-лімфоцитів, у плазмі чи в тканинах
відбувається реакція антиген – антитіло, внаслідок якої антиген знешкоджується
під час наступних імунних реакцій. Це вторинна гуморальна імунна відповідь, яка
відбувається значно активніше і швидше, ніж первинна, а також швидше (десятки
хвилин, години), ніж вторинна клітинна імунна відповідь, спричинена
Т-лімфоцитами (1-2 доби). Відповідно першу з них називають імунною реакцією
негайного, а другу – сповільненого типу.
Виходячи з
описаних вище особливостей реагування імунної системи на антиген, у медичній
практиці використовують засіб специфічної профілактики інфекційних хвороб – вакцинацію.
Вона полягає в тому, що попередньо здійснюється штучний контакт
макроорганізму з ослабленим інфекційним агентом, який не спричинює
захворювання, але зумовлює появу лімфоцитів імунологічної пам'яті до цього
антигену. У разі повторного, вже не спровокованого контакту макроорганізму з
цим антигеном лімфоцити проліферують і здійснюють ефективну імунну реакцію,
запобігаючи захворюванню.
Т- і В-лімфоцити
різняться не тільки за походженням і властивостями, а й за механізмом дії. Так,
рецептори Т-лімфоцитів відрізняють "своє" від "чужого" або
зміненого "свого" завдяки наявності на поверхні клітин антигенів
гістосумісності і специфічно реагують на певний антиген, але здійснюють імунну
реакцію за допомогою неспецифічного чинника перфорину чи інших протеаз. Що
стосується В-лімфоцитів, то розміщені на їхній мембрані рецептори і є
антитілами, що продукуються В-лімфоцитами під час імунної реакції й
безпосередньо вступають у специфічну реакцію з відповідним антигеном за межами
лімфоцита.
Обидві групи
лімфоцитів досить тісно взаємодіють між собою. Зокрема, Т-лімфоцити-хелпери
можуть активізувати синтез антитіл В-лімфоцитами, а Т-супресори, навпаки,
пригнічують гуморальні реакції антиген – антитіло, зумовлені В-лімфоцитами.
Існує також чітка взаємодія між системами, що забезпечують специфічний і
неспецифічний імунітет. Так, неспецифічний чинник – комплемент – за наявності
специфічних антитіл спричинює лізис бактерій. Макрофаги передають антигенну
інформацію про перетравлені ними мікроорганізми Т-лімфоцитам-кілерам.
2.
Механізми реакції антиген – антитіло
Антиген – це органічна речовина
біологічного походження, здатна викликати імунну реакцію. Антигеном може бути
шкідлива чи навіть нешкідлива для організму речовина, але, як правило,
чужорідна для нього. В антигені можна виділити дві частини – молекулу-носія,
імунологічно нейтральну високомолекулярну органічну сполуку, та розміщені на її
поверхні кілька низькомолекулярних груп – гаптенів, які мають органічну
чи неорганічну природу і надають усій молекулі здатності спричинювати імунну
відповідь. Такі антигени називають повними на відміну від неповних антигенів,
до яких належать речовини, зокрема гаптени, що самі не здатні викликати імунну
відповідь, але набувають такої здатності після сполучення з білком-носієм. Так,
зокрема, низькомолекулярні речовини, потрапивши до організму, можуть набувати
антигенних властивостей після їх сполучення з макромолекулами цього організму.
В такому разі вони виступають у ролі гаптенів.
Антигени є видові,
а у хребетних тварин також групові та індивідуальні, тканинні тощо.
Така висока специфічність антигенів визначається певними хімічними групами –
детермінантами специфічності, або епітопами, завдяки яким антиген
розпізнається антитілом. Детермінанта специфічності – це невелика
частина молекули антигену (4-10 амінокислотних залишків), яка безпосередньо сполучається
з рецепторною зоною антитіла.
Антитіло – це білкова
молекула, яка специфічно взаємодіє з відповідним антигеном. Усі антитіла
належать до гамма-глобулінів сироватки крові. Оскільки саме вони здійснюють
специфічний імунітет, їх називають імуноглобулінами і за низкою
ознак поділяють на 5 класів: IgM, IgG, IgA, IgE, IgD. Молекулярна маса
імуноглобулінів становить 150-200 кД.
Структурно імуноглобулін
(антитіло) складається з великої білкової молекули, в якій є відносно невелика
(до 20 амінокислот) активна розпізнавальна група – рецептор, що
забезпечує специфічність цього антитіла, яка ґрунтується на високій
відповідності (комплементарності) структури активного центру антитіла та
детермінантних груп антигену, причому відповідність має бути не тільки у просторовій
конфігурації амінокислотних радикалів обох взаємодіючих молекул, а й у їхніх
електричних зарядах (Рис. 2).
Рисунок 2
Взаємодія антигену з антитілом
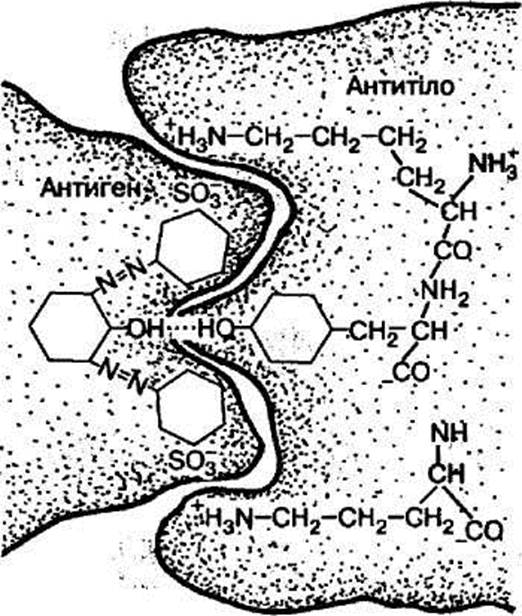
Процес
розпізнавання визначається слабкими міжмолекулярними
(вандерваальсовими) взаємодіями, які виявляються на дуже малих відстанях між
молекулами. А останнє можливе лише за повної відповідності розпізнавальної
частини антитіла детермінантам антигену. Специфічний імунітет полягає в тому,
що кожній антигенній детермінанті відповідає певне і лише одне антитіло, що
продукується групою (клоном) лімфоцитів.
Внаслідок контакту
антитіла з відповідним антигеном утворюється міцний комплекс антиген–антитіло,
в якому антиген втрачає свої патогенні властивості, нейтралізується або
знищується. В результаті можливі різні наслідки, що насамперед залежить від
валентності взаємодіючих молекул, тобто від кількості детермінантних груп
антигену та рецепторних груп антитіла; у антигену їх може бути багато, тоді як
антитіло має одну або дві рецепторні групи. У разі коли реагуючі компоненти
мають по одній контактній групі (Рис. 3, а), об'єднання комплексу
антиген–антитіло у групи не відбувається і зовнішніх проявів імунної реакції
немає. За наявності двох рецепторних груп у антитіла і кількох детермінант на
антигені можуть утворюватись великі групи молекул: відбувається їх склеювання,
осадження тощо (Рис. 3, 6 –г).
Рисунок 3
Форми комплексів антиген – антитіло
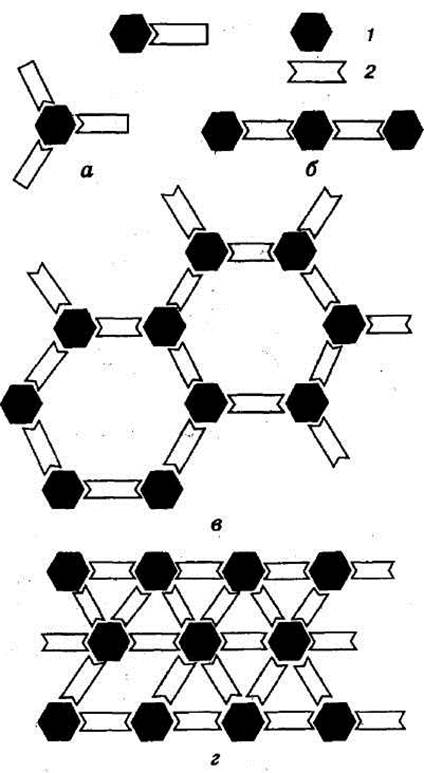
1 –антиген; 2 – антитіло;
антитіло має одну контактну
групу (рецептор) (а); антиген – дві (б), три (в), шість (г)
детермінантних груп
Серед імунних
реакцій найбільш вивченими є такі.
Реакція
преципітації – осадження комплексу антиген–антитіло внаслідок
агрегації окремих комплексів у більші часточки та випадання їх в осад. Розчин
при цьому мутніє.
Реакція аглютинації – склеювання
часточок (бактерій, клітин або їхніх частин) відповідним антитілом. У
результаті утворюються великі скупчення – грудки часточок, помітні неозброєним
оком, як, наприклад, при аглютинації еритроцитів у плазмі несумісної групи
крові. Реакція аглютинації, як і попередня, здійснюється за участю бівалентних
(повних) антитіл.
Реакція лізису – розчинення
клітин або їхніх компонентів під впливом специфічних антитіл. Ця реакція, як
правило, виникає після аглютинації клітин і відбувається за обов'язкової участі
комплементу – сукупності багатьох неспецифічних білкових факторів
сироватки крові, здатних підсилювати імунні реакції.
У макроорганізмі
описані вище імунні реакції відбуваються в певній послідовності й тісному
взаємозв'язку. Внаслідок здійснення складного комплексу цих та інших реакцій
розвивається імунна відповідь, що призводить до знищення (елімінації) антигену.
За нормальних умов
в організмі немає антитіл до власних антигенів. Неприродним є явище вироблення
таких антитіл – аутоантитіл. Воно спостерігається найчастіше у відповідь
на появу власних антигенів, змінених під впливом різних чинників: токсинів,
вірусів, бактерій, хімічних чи фізичних (лікарських засобів, опромінювання,
опіку тощо), або після деяких захворювань, наприклад антикардіальні антитіла у
хворих після повторного інфаркту міокарда. Такі антитіла провокують або
посилюють патологічний процес і таким чином втрачають свою захисну
спрямованість. Ще одним відхиленням у функції імунної системи є алергічна
реакція.
Біологічне
значення реакцій антиген - антитіло полягає у
знешкодженні патогенного агента і підтриманні нормального функціонування
макроорганізму. Проте в деяких випадках розвивається надмірна чутливість (гіперсенсибілізація)
організму до якогось антигену, іноді навіть біологічно нейтрального –
запаху якоїсь рослини, розчину нешкідливої речовини тощо. І тоді вторинна
імунна відповідь може бути настільки інтенсивною, що може завдавати шкоди цьому
організмові. Розвивається алергічна реакція: утруднення дихання
внаслідок бронхоспазму, почервоніння й висипання на шкірі, відчуття свербіння
тощо. У таких випадках вдаються до пригнічення імунної системи організму
лікарськими засобами. Цей самий прийом використовують також, щоб запобігти
відторгненню пересадженого людині органа, адже повної імунної сумісності
органів донора й реципієнта практично досягти не вдається.
Нині поняття
імунітету означає здатність організму
розпізнавати і знищувати чуже. При цьому під чужим розуміють не
тільки патогенні мікроорганізми, токсини, перелиту кров чи трансплантат, а й
мутантні клітини власного організму.
Таким чином, імунітет – це система захисних реакцій організму,
спрямованих на підтримання генетичної сталості індивідуума.
3.
Тромбоцити
Тромбоцити – третя група
клітин крові, які відрізняються від еритроцитів і лейкоцитів за формою та
розмірами. Це круглі двоопуклі утвори заввишки до 0,7 мкм і діаметром 1-4 мкм.
На відміну від лейкоцитів, тромбоцити ссавців не мають ядра. Крім того, вони
позбавлені будь-яких пігментів, чим істотно відрізняються від інших без'ядерних
клітин крові ссавців – еритроцитів. Кількість тромбоцитів у людини в нормі
становить 200 – 400 тис. в 1 мкл крові. Вони утворюються в кістковому мозку
відщепленням невеликих часточок цитоплазми від великих кровотворних клітин – мегакаріоцитів.
З однієї такої клітини може утворитись близько 4000 тромбоцитів. Мембрана
тромбоцитів нестійка до механічних впливів, вона легко руйнується, і тому
тривалість їхнього життя в крові не перевищує 10-12 діб. Тромбоцити виявляють
здатність скупчуватись у групи (агрегація) й прилипати до чужорідних
агентів чи ушкоджених поверхонь судин (адгезія), внаслідок чого
утворюється тромбоцитарний (пластинчастий) тромб.
У цитоплазмі
тромбоцитів містяться гранули, заповнені фізіологічно активними речовинами:
адреналіном, гістаміном, а також ферментами гліколізу, дихального циклу,
АТФазою, АТФ тощо. Тут містяться також тромбоцитарні фактори згортання крові.
Тромбоцити здійснюють також фагоцитоз небіологічних часточок, вірусів,
комплексів антиген – антитіло і таким чином беруть участь у підтриманні
неспецифічного клітинного імунітету.
Система згортання крові.
Згортання (коагуляція) крові
є проявом захисної реакції організму – гемостазу, спрямованої на
збереження об'єму циркулюючих рідин тіла: крові, лімфи чи гемолімфи, зокрема на
запобігання крововтратам.
Згортання крові у
хребетних є складним процесом, в основі якого, за теорією Шмідта–Моравиця,
лежать ферментативні реакції. Згідно з поширеною каскадною концепцією більшість
факторів згортання крові перебувають у стані неактивних проферментів і
послідовно під впливом своїх попередників перетворюються на активні ферменти:
профермент А, перетворившись на фермент А, діє на профермент Б, перетворюючи
його на фермент Б, а той, у свою чергу, активує профермент В і т. д. У процесі
багатоступінчастих перетворень, у яких бере участь близько двох десятків
речовин – факторів згортання крові, утворюється згусток фібрину. Цей
згусток виникає в місці ушкодження судини, закриваючи отвір, через який витікає
кров.
Розрізняють два
механізми гемостазу: судинно-тромбоцитарний (первинний) і коагуляційний
(вторинний). Ці механізми вмикаються за різних умов, у різних ділянках судинної
системи і здійснюються за участю різних факторів згортання крові.
Судинно-тромбоцитарний
(первинний) гемостаз відбувається після незначних травм, ушкоджень дрібних
кровоносних судин з низьким тиском крові. При цьому руйнуються не тільки
тканини, а й тромбоцити, з яких у кров виходять серотонін (тромбоцитарний
фактор 10), а також адреналін і норадреналін, які звужують судини, зумовлюючи
короткочасне зменшення чи навіть зупинення кровотоку в ушкодженій судині.
Одночасно відбувається адгезія й агрегація тромбоцитів і утворення тромбоцитної
пробки, що закриває ушкоджену мікросудину. Ці процеси активуються
тромбоцитарними факторами F5, F6 та F11. Фактор F6 – тромбостенін – за
рахунок енергії АТФ, який виходить зі зруйнованих тромбоцитів, спричинює
скорочення ниток фібрину і в такий спосіб здійснює ретракцію згустку –
ущільнює тромбоцитиий тромб. У ході агрегації та руйнування тромбоцитів
відбувається також вивільнення F3 – тромбоцитарного тромбопластину, що є
одним із факторів запуску коагуляційного гемостазу.
Коагуляційний
(вторинний) гемостаз відбувається в більших артеріях, де високий тиск не дає
змоги закріпитися тромбоцитарним тромбам. Тут утворюється міцніший фібриновий
тромб. Коагуляційний гемостаз поділяють на три фази, кожна з яких складається з
послідовних ферментативних реакцій, здійснюваних факторами згортання крові.
Переважна більшість цих факторів синтезується в печінці.
Ми розглянули
механізм згортання крові до утворення тромбу. Виділяють ще дві фази, які
логічно завершують процес гемостазу і відновлюють кровопостачання ушкодженої
тканини. Це четверта фаза – ретракції згустка, під час якої нитки
фібрину скорочуються, що робить тромб щільнішим і меншим. При цьому краї рани
за рахунок скорочення прикріплених до них ниток фібрину зближуються, що
полегшує її загоєння.
Під час останньої,
п'ятої фази – фібринолізу відбувається розчинення тромбу і відновлення
кровотоку (якщо тромб перекривав просвіт судини).
4.
Протизгортальна система крові
Оскільки всі
фактори згортання містяться в крові, мікротравми судин і тканин трапляються
досить часто, а руйнування та відмирання клітин крові – це нормальне
фізіологічне явище, то цілком зрозуміло, що система згортання крові постійно
активується і утворюється деяка кількість фібрину. Цей процес урівноважується
утворенням відповідної кількості плазміну, який розчиняє мікрозгустки фібрину.
Крім того, в
організмі існує й активно функціонує протизгортальиа система, яка за нормальних
умов добре врівноважена із системою згортання крові (коагуляційною) так, що
ймовірність спонтанної коагуляції крові зведена до мінімуму. До
протизгортальної системи входять ендотеліальиі клітини, що вистеляють внутрішню
поверхню судин. Завдяки особливостям її будови та специфічним речовинам, що
містяться на ній, тромбоцити відштовхуються від неї, що протидіє їх адгезії та
агрегації. До речовин, які протидіють згортанню крові, можна віднести також гепарин,
що синтезується в печінці, легенях, м'язах, базофільних гранулоцитах
сполучної тканини (тучних клітинах) і гальмує утворення тромбіну; а також тромбомодулін
та фібрин, що зв'язують тромбін. Порушення рівноваги між системами
згортання крові і протизгортальною призводить до погіршення (гіпокоагуляція)
або підвищення (гіперкоагуляція) згортання крові. Обидва відхилення небезпечні
для організму: перше – значними крововтратами, а друге – можливістю утворення
тромбів і закупорювання кровоносних судин – тромбоемболією. Гіпокоагуляція може
виникати внаслідок захворювання печінки, яка синтезує більшість факторів
гемостазу, або зниження тромбопоезу, зменшення кількості тромбоцитів у крові.
Прикладом гострої гіпокоагуляції є гемофілія – спадкова хвороба,
небезпечна великими крововтратами через відсутність у крові одного з факторів. Гіперкоагуляція
виникає при запаленні внутрішньої стінки судин, коли порушується гладкість
поверхні ендотеліальних клітин і тромбоцити починають скупчуватись у місцях
запалення з подальшим їх руйнуванням; при погіршенні венозного відтоку, застою
крові у розширених і звитих венах нижніх кінцівок. Гіперкоагуляція може бути і
нормальним фізіологічним явищем, якщо вона виникає у випадках поведінкової
захисної реакції, фізичного навантаження чи емоційного напруження. Ці факти
свідчать про те, що процес згортання крові регулюється нейрогуморальними
механізмами.
5.
Кровотворення і його регуляція
Вище зазначалось,
що еритроцити в крові людини живуть у середньому 120 днів, а тромбоцити і
більшість лейкоцитів – ще менше і поступово відмирають. На зміну їм надходять
нові клітини крові, утворення яких – кровотворення (гемопоез)
безперервно відбувається в організмі. У дорослої людини в нормі щодоби
утворюється і надходить у кров 25 · 1010 еритроцитів, 5 · 1010
лейкоцитів і 50 · 1010 тромбоцитів. Як видно, швидкість утворення
різних форм клітин крові залежить насамперед не від їх кількості, а від
тривалості їхнього життя. Місцями утворення клітин крові у дорослої
людини є червоний кістковий мозок і лімфатичні вузли. На ембріональній стадії,
а також у дорослих у разі патології кісткового мозку кровотворну функцію
виконують селезінка і печінка.
У червоному
кістковому мозку містяться стовбурові клітини, які за сучасною
термінологією є плюрипотентними некомітованими клітинами, тобто такими,
що несуть у собі задатки до утворення клітин – попередниць усіх клітин крові,
але здатними у процесі поділу утворювати лише собі подібні клітини –
здійснювати самооновлення і розмноження стовбурових клітин. На певній стадії
цього процесу утворюються комітовані клітини. Вони також мультипотентні,
однак під час їх поділу вже виникають диференційовані клітини-попередниці: одна
з таких стовбурових кровотворних клітин кісткового мозку внаслідок поділу
утворює дві клітини – мієлоїдну і лімфоїдну стовбурові клітини,
кожна з яких дає початок відповідним процесам: мієлопоезу – утворенню
еритроцитів, гранулоцитів і тромбоцитів і лімфопоезу – утворенню і
диференціації лімфоцитів.
Органічні
компоненти крові. В еритроцитах міститься речовина, якої немає в жодній іншій
клітині тіла хребетних. Це гемоглобін, який синтезується у кістковому
мозку за участю вітамінів групи В та інших. Для синтезу гемоглобіну
використовується залізо відпрацьованого гемоглобіну і лише невелика частка
заліза (не більш як 1 мг на добу), що надходить з їжею.
Основна маса
білків плазми крові синтезується в печінці, інші органічні компоненти надходять
з травного каналу або з тканин тіла (метаболіти). Вуглеводи потрапляють у кров
через печінку, де більша частина вуглеводів їжі депонується, а ліпіди надходять
разом з лімфою. Білки, ліпіди і вуглеводи перебувають у крові переважно у
вигляді ліпо- та глікопротеїдів.
Регуляція
кровотворення. Відомо, що в умовах гіпоксії у людини різко зростає
кількість еритроцитів у крові; після крововтрати швидко відновлюється клітинний
склад крові. Ці факти свідчать про наявність в організмі людини регуляторних
систем, які підтримують сталість складу крові. Основним чинним фактором таких
систем є гемопоетини, зокрема, кількість еритроцитів контролює еритропоетин
– високомолекулярний глікопротеїд, 85% якого утворюється в нирках, решта –
в печінці. Він стимулює утворення і розмноження клітин-попередниць еритроїдної
лінії.
Лейкопоетини – це група
речовин, серед яких є фактори, що вибірково активують розмноження кожного виду
лейкоцитів. Крім того, на проліферацію лейкоцитів впливають фактори, виділювані
патогенними мікроорганізмами і чужорідними клітинами. Тромбоцитопоез
регулюється тромбопоетином, який стимулює продукування і
дозрівання мегакаріоцитів. Процеси кровотворення перебувають також під
контролем автономної нервової та ендокринної систем.

