Тема 6. РОЗМНОЖЕННЯ
РОСЛИН МЕТОДОМ КУЛЬТУРИ ТКАНИН – IN VITRO
План:
6.1.
Метод культури тканин
6.2. Типи
та основні етапи мікророзмноження
6.3. Оздоровлення
садивного матеріалу
6.4. Практичне
значення методу мікроклонального розмноження
6.1. Метод культури тканин
В
залежності від виду і розміру тканини методи культури тканин бувають: сіянцеві;
вегетативні; калусу; протопласта; соматичних ембріонів.
В
практичному застосуванні найбільшого поширення набув метод вегетативного мік-ророзмноження
при якому в якості вихідного матеріалу є довільна вегетативна частина рослини. При цьому методі найчастіше застосовують:
- культуру
верхівкової (апікальної) меристеми яка передбачає
використання в якості вихідного матеріалу звичайних верхівкових меристем, які в
подальшому використовують-ся для репродукції нових поколінь. Це означає, що
апікальна меристема відділяється від материнської рослини і продовжує
розвиватися в асептичних умовах як мініатюрний пагін (живець). Апікальна
меристема і сама верхівкова сферична її частина із зачатковими листками
зазвичай є вільною від вірусів навіть у системно інфікованих рослин.
Репродукція нових рослин з верхівкової меристеми використовується для
отримання оздоровлених (вільних від патогенів) рослин для промислового
розмноження гвоздик і хризантем. Процес оздоровлення рослин включає термотерапію, яка буває двох
видів:
-
короткочасна
(1,5-4,0
год.) проводиться нагрівання всієї рослини до температури 44-57 °С
шляхом занурення всієї рослини або її частини у воду чи перенесення в
термо-стат для знищення грибів,
вірусів і нематод.
- тривала - (2-3
тижні) вся рослина поміщається в умови помірно підвищених темпе-ратур (37-38
°С). В таких умовах віруси не знищуються проте ефективно імобілізуються (стають
нерухомими). За час прогрівання верхівкова меристема продовжує рости і таким
чином новоутворений приріст є вільним від патогенів. Кожна з цих верхівкових
меристем і буде вихідним матеріалом для отримання оздоровлених рослин. Проте, ніколи
ми не мо-жемо стверджувати, що отримана таким чином меристема є вільною від
внутрішніх па-тогенів. Для цього існують методи виявлення патогенів у рослинах:
-
візуальна інспекція. Часто про наявність патогенів
у рослині можна судити по хара-ктерних змінах у формі і забарвленні листя,
пагонів і плодів;
-
ідентифікація по культурі
тканин. Після поверхневої стерилізації
експлант поміща-ють у середовище, сприятливе для розвитку патогенів, які згодом
можна виявити візуаль-но або шляхом
проведення біохімічних тестів;
- ідентифікація вірусів -
найстаріший спосіб виявлення латентних форм вірусів у рос-линах.
Проводиться шляхом щеплення або окулірування досліджуваної рослини на
рос-лину-індикатор, у якої при наявності вірусів формуються характерні ознаки;
- серологічний тест - дозволяє ідентифікувати
будь-які віруси, шляхом виявлення уні-кальних для кожного виду патогенів
протеїнів (білку), проведення автоматизованого тесту ЕЛISА. Її суть полягає у введенні
досліджуваної субстанції у кровоносну систему кроли-ка, де при наявності
вірусів виробляються специфічні антитіла. Після забору крові фракція сиворотки
містить ці антитіла, наявність або відсутність яких підтверджується
проведен-ням тесту.
Метод
культури верхівкової меристеми застосовується для масового розмноження, проте
лише отримані з них рослини, після підтвердження їх безвірусного статусу є
дже-релом вихідного матеріалу для прискореної мультиплікації клонів.
Культура
латеральної (аксилярної) меристеми - найбільш поширений метод
масового розмноження рослин в культурі тканин. Вихідним матеріалом для
ініціації культури може бути будь яка частина рослини, яка є найбільш готовою
для активного росту, найменш ураженою і найбільш генетично стійкою. Такою
частиною є латеральні (бічні) пагони і па-зушні (аксилярні) бруньки. На відміну
від апікальних меристем вони є більш генетично стійкими і менше піддаються
мутаціям.
6.2.
Типи та основні етапи мікророзмноження
Метод
мікроклонального розмноження грунтується на індукованому фітогормонами рості
верхівкових та пазушних меристем, кожна з яких започатковує осередок пагонів.
Пі-сля формування такого осередку його поділяють на дрібніші групи пагонів,
переносять на свіже середовище, і процес повторюється. Швидкість
мікроклонального розмноження за-лежить від виду і, навіть, сорту або лінії
рослини, але часто можливо отримувати із окре-мої бруньки до кількох мільйонів
рослин за рік.
Залежно від характеру морфогенетичних процесів (способів одержання
рослин-реге-нерантів) в культурі тканин розрізняють типи (методи)
мікроклонального розмноження, в основі яких лежать відмінності одержання рослин
(з уже існуючих у рослин in
vitrо або
новоутворених in
vitro ініціалей).
Перший
- рослин формуються внаслідок активації існуючих в інтактній рослині
мери-стем (апекс стебла, пазушні і сплячі бруньки стебла), тобто шляхом прямого
морфогенезу. Ці рослини, регенеровані з меристем, генетично ідентичні
батьківським формам.
Другий
- рослини формуються в результаті
індукції виникнення бруньок або ембріо-їдів. Такі рослини, отримані зі
спеціалізованих і калусних клітин, яким властива генетич-на мінливість, нерідко
відрізняються від батьківських. Цей метод застосовується до рос-лин, у яких
калюс відрізняється генетичною стабільністю і коли варіабельність між
росли-нами-регенерантами не перевищує рівня природної мінливості.
Вважається, що утворення рослин-регенерантів безпосередньо з експланта
(шляхом активації існуючих меристем, утворення бруньок чи ембріоїдів)
характеризує прямий мор-фогенез. Активація росту пазушних бруньок і
використання пазушних пагонів - найпоши-реніший тип мікроклонального
розмноження рослини. На рослині в умовах
in
vitro ріст
пазушних бруньок пригнічується апікальним домінуванням, а ріст пазушних
меристем стимулюється видаленням верхівки стебла або обробкою цитокінінами. Введення
в по-живне середовище цитокінінів пробуджує бічні бруньки і спричинює розвиток
численних нових бруньок, так званих розеток-бруньок. Формується пучок пагонів,
що швидко росте, його розділяють на дрібніші пучки із загальною кореневою
системою або на окремі па-гони, які спроможні утворювати під час вирощування на
свіжому поживному середовищі ідентичні пучки (розетки) бруньок і пагонів.
Для індукції пазушних бруньок важливо правильно підібрати концентрацію
фітогор-монів у середовищі. Велика кількість цитокінінів сприяє розвитку
пазушних бруньок, змі-нюючи морфологію рослини яка призводить до появи
аномальних і вироджених форм. Надлишкова кількість ауксину індукує розвиток
калюсу, який пригнічує ріст меристемної тканини або спричинює розвиток
додаткових стеблових апексів, що генетично відрізня-ються від вихідної рослини.
У таких випадках ауксин із середовища вилучається або його кількість зводиться
до мінімуму.
Культивування тканин стебла з пазушними
бруньками на поживному середовищі при-зводить до утворення нормального пагона,
який формує рослину. Для прискореного розм-ноження перший пагін після
формування 5-7 листків розділяють на живці завдовжки 1,0-1,5 см з одним
листком, розсаджують у пробірки з аналогічним поживним середовищем. Бруньки або
ембріоїди можуть виникати: безпосередньо із спеціалізованих тканин експ-ланта
(тканин репродуктивних органів, епідермісу, субепідермальних тканин, мезофілу
листка); з первинного калюсу, утвореного клітинами експланта; із
субкультивованої ка-люсної тканини або клітин суспензійної культури.
Методом індукції пазушних бруньок у
культурі тканини розмножують плодово-ягідні і декоративні культури, капусту,
картоплю і багато інших. Він гарантує максимальну ге-нетичну однорідність
рослин - регенерантів. Розмноження рослин пазушними пагонами є найповільнішим
шляхом із відомих типів органогенезу.
При мікророзмноженні (живцюванні) використовують придаткові пагони.
Метод ґру-нтується на здатності рослин утворювати пагони безпосередньо із
спеціалізованих тканин експланта. Окремі клітини ізольованих тканин рослин
дедиференціюються з наступним утворенням меристемних осередків, в яких
закладаються стеблові бруньки (спостерігає-ться гемогенез). Розвиток
адвентивних (придаткових) пагонів проходить за рахунок біч-них і інтеркалярних
меристем, внаслідок чого новоутворені рослини генетично ідентичні батьківській
формі. В утворених меристемних осередках культивованого експланта про-цес
диференціювання іноді спрямовується шляхом формування ембріоїдів. Цей тип
реге-нерації характерний для трав'янистих рослин у разі використання як
експлантів фрагме-нтів листків, лусок, цибулин, бульбоплодів, стебел, кореневищ
тощо.
Часто в прискорених циклах культивування з метою запобігання зниженню
активності регенерації і появи мінливості у регенерованих пагонів
використовують для регенерації калюсну тканину, яка виникає на експланті на
місці зрізу (первинний калюс). У цьому ви-падку утворення коренів у
регенерованих пагонів часто відбувається спонтанно при пере-несенні їх на
середовище без цитокінінів. Отримані рослинки розглядають як невеликі укорінені
живці. Вважається, що така система мікророзмноження володіє найменшим ри-зиком
для виникнення генетичних порушень і, порівняно з традиційними методами, цей
шлях розмноження значно економить час, необхідний для отримання посадкового
мате-ріалу, і виробничі площі, збільшуючи багатократно коефіцієнт розмноження.
Крім фрук-тових, винограду та квіткових культур цю систему застосовують для
розмноження ягідних та овочевих, наприклад, малини, суниць, чорниць, люцерни,
цукрових буряків, капусти, томатів, тютюну та багатьох інших.
Отже, не тільки кожному виду рослин, а й навіть окремим тканинам
властива конк-ретна морфогенетична реакція, що використовується для
мікроклонального розмноження в культурі in vitro із
забезпеченням генетичної стабільності у межах нормальної спонтан-ної
мутабільності рослин.
Мікроклональне розмноження включає 4
етапи, кожен з яких має свою чітку мету: ініціація культури; мультиплікація
пагонів; укорінення та дорощування.
-
стадія 1 - ініціація культури. Перший
етап мікроклонального розмноження рослин або їх частин розпочинається із
перенесення частини тканини рослини (експланта) в спе-ціальні умови для його
подальшого розвитку. Він складається з чотирьох завдань:
-
вибір місця відбору вихідної тканини (експланта);
-
дезинфекція експланта;
-
розміщення експланта на середовище;
-
стабілізація культури.
Вибір меристемної рослини. Бажано,
щоб вихідні рослини не були ушкоджені гриб-ковими, бактеріальними і вірусними
хворобами. Цибулини, кореневища і бульби перед введенням в культуру іп vitro
попередньо
обробляють високими або низькими температу-рами протягом різного часу - від
кількох годин до кількох місяців.
Першим рішенням, котре слід прийняти є
вибір найбільш придатної для розмноження частини рослини з якої виділяється експлант.
Теоретично розпочати розмноження можна з будь-якої частини тканини рослини,
проте з точки зору практичної доцільності вибір слід зупинити на тканинах,
котрі готові для росту, найменш забруднені і на які легко впливати. В
переважній більшості випадків цією частиною є пазушна брунька або бічний пагін,
хоч у випадку з рослинами родини папоротей вихідною тканиною буде частина
столона. Роз-мір вихідної тканини (експланта) зазвичай є дуже малим (довжиною 1-
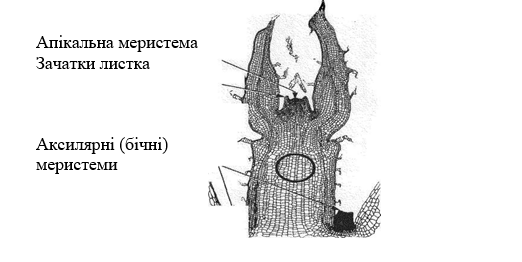
Малюнок 5.1. Конус
наростання в рослині
Вибравши відповідну вихідну частину материнської рослини для подальшого
розмно-ження, відділяють необхідну частину відповідного розміру і проводять її
поверхневу де-зинфекцію (стерилізацію). Поверхнева дезинфекція це процес
видалення забруднення (ві-русів, бактерій, грибів тощо) тільки з поверхні
рослинного матеріалу, а не з внутрішньої її частини. Вона передбачає
застосування хімічних речовин, котрі є токсичними для мікро-організмів і
нешкідливими для рослини. Основні дезинфектанти місять алкоголь (80-90% спирт):
етил, метил, ізопропіл або хлорвмісні відбілювачі (хлорид кальцію, гіпохлорид
на-трію в концентрації 5-6 % активного компонента). Перед застосуванням
відбілювач розба-вляють до концентрації у 10-20 % і додають кілька крапель ПАР
(поверхнево-активних речовин: Сільвет,
Citowet, Agral, SuperAm).
Ефективність стерилізації при застосуванні відбілювача залежить від
концентрації ро-зчину і тривалості дезинфекції - при довготривалому утриманні
експланта при високій ко-нцентрації відбілювача ефект буде найкращим, проте і
пошкодження живих клітин теж значними. Тому для кожного виду рослин необхідно
встановити оптимальне компромісне співвідношення тривалості - концентрації.
Додатковими сполуками для проведення стерилізації можна вважати перекис
водню, нітрат срібла, нітрат ртуті, хлорид меркурію, проте по причині
токсичності останнього застосування його є обмеженим.
Типова процедура поверхневої дезинфекції приготовленого експланта
зводиться до прополіскування його в колбі з дистильованою водою та додаванням
відбілювача і пове-рхнево активних речовин протягом 5-15 хвилин. Потім експлант
протягом кількох хвилин промивається дистильованою водою 2-3 рази для видалення
розчину відбілювача. Для експлантів деревних порід їх можна додатково
простерилізувати короткочасно занурюючи у спирт. Модифікаціями базової
процедури є додаткове промивання водою перед стери-лізацією, застосування
механічних мішалок під час стерилізації та кількаразова стерилі-зація.
Таким чином підготовлену частину рослини
переносять у стерильну посуду (чашку Петрі). Використовуючи простерилізований
(вмочені у спирт і пропалені на вогні спиртів-ки робочі частини) інструмент
(скальпель та пінцет) експлант подрібнюється на кілька ча-стин, які
висаджуються на поживне середовище. Кількість експлантів в одній посудині
залежить від культури і розміру посуди (картопля - 1, суниця - 4 і більше).
Після висадки експлантів на середовище, чашки Петрі, пробірки закривають
і герме-тизують спеціальною стрічкою. Цю роботу проводять в лабораторних умовах
під спеціа-льною витяжкою із зворотньою подачею повітря, яке попередньо
проходить через надтон-кий фільтр, який вловлює бактерії, спори та інші
патогени. Контейнери з тканинами пере-носять в умови регульованого середовища.
Основними параметрами якого є:
Температура.
Оптимальними її значеннями є +20...+27 °С. Вищі температури можуть пригнічувати
вплив цитокініну на галуження експланта. Більшість лабораторій дотриму-ються
практики підтримування постійної температури. Однак, для оптимального розвитку
окремих культур (формування бульбочок у лілій) необхідно знижувати температуру
про-тягом нічного циклу. Температура є визначальним фактором для гальмування
інтенсив-ності росту культур. Так, при промисловому розмноженні у періоди
зниження попиту на рослини виникає необхідність законсервувати виробництво, що
досягається шляхом зни-ження температури до мінімального рівня, коли рослини не
гинуть і майже не ростуть. В цьому випадку відпадає необхідність у проведенні
необхідних, згідно технології, робіт (пересаджувань).
Світло.
Його вплив на ріст і розвиток рослин залежить від світлового
випроміню-вання (ФАР), тривалості (фотоперіоду) та спектру. Інтенсивність
світлового випроміню-вання для мікророзмноження коливається в межах 40-80 y тmol х m2 х sec1 на
рівні експ-лантів, але інтенсивність освітлення в середині контейнерів може
бути нижчою, що зале-жить від матеріалу в яких відбувається їх ріст і розвиток.
Рослин відрізняються вимогливі-стю до світла, проте рівень освітлення при
мікророзмноженні є значно нижчим у порів-нянні з теплицями і відкритим ґрунтом
(600-1200 y
mol х m2 х sec1).
Низький рівень освіт-лення пояснюється тим, що при високій його інтенсивності
та низькому вмісту СО2 в умо-вах
закритих контейнерів може призвести до відмирання хлорофілу і утворення
некрозів на листі і в тканинах культури - основним джерелом вуглеводів у цей
період є поживне середовище.
Фотоперіод теж відіграє певну роль - достатнім для розвитку культур є 12
годинний світловий день. Оптимальними умовами розвитку є 16 годинний світловий
день і 8-ми го-динний нічний цикл. Шляхом зміщення співвідношення день - ніч у окремих культур мо-жна
штучно викликати фізіологічні зміни: якщо у гвоздики тривалість дня становить
16 годин то вони будуть утворювати квітки, при 12 годинному світловому дні вони
будуть лише рости.
Для освітлення використовуються флуоресцентні лампи з білим денним
світлом, інко-ли додають тепличні лампи (з червоним спектром світла). Скляні
контейнери не пропус-кають світлового спектру нижче 290 нм, пластикові
контейнери - менше 390 нм, але най-більш ефективним для органогенезу є спектр
400-800 нм. Встановлено, що світло різного спектру впливає на органогенез:
червоний спектр сприяє росту пагонів (у герані), голубий пригнічує їх ріст та
галуження, стимулюючи утворення хлорофілу і збільшення площі листкової поверхні
(у берези). Червоний та інфрачервоний - сприяють утворенню бульб у тюльпанів та
покращують укорінення фікуса та фрезії в порівнянні із застосуванням голу-бого
спектру. Встановлено, що висока інтенсивність освітлення пригнічує
коренеутво-рення.
Газовий
склад повітря - теж
має вплив на ріст культури. В промислових лабораторіях цьому питанню майже
ніколи не приділяють достатньої уваги, оскільки контейнери з ку-льтурою тканин
ніколи герметично не закривають і газообмін все ж відбувається. Оскі-льки СО2
є ключовим елементом для фотосинтезу у зелених рослин, то збільшення його
вмісту у газовому середовищі позитивно впливає на інтенсивність і ефективність
цього процесу. Мінімальним рівнем по вмісту вуглекислого газу в повітрі - 0,035
% концентра-ція. Встановлено, що при 0,3–5,0 % концентрації у більшості культур
значно інтенсивніше відбувається ріст і укорінення, однак такі умови можуть
бути небезпечними для перебу-вання в них людини.
Типовими умовами при мікророзмноженні є: температура повітря +25 °С, 16
годин-ний період освітлення, інтенсивність освітлення 5000-10000 люксів. В
таких умовах експ-лант проходить такі етапи:
- фаза ізоляції. Після висаджування
експланта на середовище відбувається
інтенсив-ний його ріст за рахунок власних тканин. Частинка пагона
продовжує рости в довжину без утворення розгалужень і бічних пагонів;
- фаза стабілізації. Під час її
проходження можуть відбуватися неконтрольовані і не-сподівані варіанти розвитку
і росту культури - недостатнє галуження, нерівномірний ріст пагонів тощо. Легко
стабілізуються експланти із однорічних трав'янистих культур та де-ревних порід
(якщо експлант взято з рослин в ювенільному віці). Експланти, що походять з
дорослих і старих рослин для стабілізації вимагають декількох пересаджувань на
нові се-редовища тривалого періоду (кілька місяців), проте інколи стабілізувати
культуру не вдає-ться. При успішній стабілізації культури вона добре росте,
утворюючи достатню кількість однакових за розміром пагонів.
Завершення першого етапу мікророзмноження наступає через 4-6 тижнів,
коли незаб-руднені інфекцією культури утворюють кілька однакових пагонів.
Найсприятливішими умовами для проліферації (галуження) пагонів є: вміст
сахарози (глюкози) в поживному середовищі 0,1 моль/л (34,2 г/л) та форми
середовища з високим вмістом мінеральних со-лей (Мурасіге-Скуга,
Кворина-Лепуавра). При масовому розмноженні до середовищ необ-хідно додавати
високі концентрації цитокініну (бензиламіно-пурину, БАП) - 0,5-1,0 мг/л. На
етапі проліферації позитивний ефект забезпечує застосування гіберелінової
кислоти (ГК) - 1-2 мг/л, ауксину (індолілмасляної кислоти, ІМК) у дозі 0,4 мг/л
на фоні 1 мг/л БАП і 1 мг/л ГК сприяло доброму галуженню.
У
фазі вкорінення оптимальною дозою ауксину (ІМК) у поживному середовищі є
0,5-1,0 мг/л. Використання ІМК 0,8 мг/л + „Рибав" 10-3 концентрації сприяли високому
сту-пеню укорінення і розвитку рослин. Для досягнення 100 % укорінення
проводять вип-робування кількох середовищ: VI Пієріка,
VI 65, 7г 01, VI /Л/РМ,
оскільки різні типи під-щеп укорінюються краще в різних середовищах.
Пересаджування вкорінених рослин в культиваційні споруди краще проводити
у кінці травня, приживання яких у цьому випадку є найвищим – 90 % і до
завершення вегетації рослини мали добре розвинену надземну і кореневу систему.
Найкраще розвинені рослини висотою 20-30 см і діаметром 5-6 мм отримували при
схемі садіння 10х10 см. При густі-шому висаджуванні (5x5 та 7х7 см,) вихід був меншим (50-55 %). У відкритий грунт рос-лини краще висаджувати восени,
оскільки після весняної
посадки значна їх частина ги-не від посухи. Після закінчення вегетації у
відкритому ґрунті, залежно від погодних умов,
висота рослин становить 70-120
см, діаметр штамбика - 7-10 мм.
Мікробна інфекція. (дріжджові
та інші гриби та бактерії) зазвичай з'являються на по-верхні середовища через
кілька днів - до тижня часу у вигляді білого, сірого або кольоро-вого міцелію. Якщо
при візуальному обстеженні виявлено мікробне забруднення тоді всі посудини, що
їх містять повинні бути знищені шляхом прожарювання в автоклаві. Деяке
мікробіологічне забруднення, викликане Васillus subtilis, Erwinia, Pseudomonas може
зна-ходитися в рослині без видимих ознак протягом кількох місяців від ініціації
культури або інкубації. Тому інколи, при ймовірності ризику наявності цих
патогенів, до складу середо-вища додаються антибіотики.
Стадія
2. Мультиплікація пагонів (розмноження культури). Після 4-6
тижнів після ініціації, в стабілізованих культурах тканин відбувається
проліферація пагонів (їх галу-ження). При утворенні певної кількості однакових
пагонів вони є придатними для переса-джування (субкультури). Кожен пагін, за
допомогою скальпеля і пінцета в стерильних умовах під витяжкою, відділяється
від загальної маси і розрізають на кілька живців або висаджують цілий на нове
середовище аналогічного складу як і попереднє. Звичайним на цій стадії
розмноження є висаджування значної кількості отриманих живців у контейнери (по
20-30 шт/один), оскільки культури пройшли фазу ініціації і тепер ризик
мікробного забруднення є значно нижчим. Великі контейнери також
використовується у випадку раціонального використання площі в лабораторії і для
підвищення ефективності вирощу-вання продукції. Поділені на частини пагони
поміщаються в такі ж інкубаційні умови як і на першому етапі. Протягом
наступних 4-6 тижнів відбувається ріст їх вегетативної маси і проліферація
(пагоноутворення). Це означає, що розмноження і пересаджування культур можна
проводити кожних 4-6 тижнів на регулярній основі.
В
культурі тканин у рослин зникає необхідність у стані спокою, тому відпадає
необ-хідність чекати закінчення стану спокою. З цього можна зробити висновок,
що лаборатор-ну стадію мікророзмноження в контрольованих умовах можна проводити
протягом року, що дозволяє налагодити безперервне промислове виробництво. Для
його проведення не-обхідно створити банк (запас) вихідних культур з яких кожних
4-6 тижнів нарізаються мікроживці для подальшого вирощування.
При створенні оптимальних інкубаційних умов
та відповідного середовища, кожен вид рослин забезпечує прогнозовану кількість
пагонів протягом всього циклу розмножен-ня. Їх кількість називається
коефіцієнтом розмноження. Знання даного показника необ-хідне для планування
кількості вихідних культур для отримання
необхідної кількості па-гонів, що будуть переходити до наступної фази
розмноження. Наприклад: для отри-мання 2000 пагонів папороті, при умові
щомісячного поділу культури (кожних 4 тижні) та коефіцієнті розмноження - 5 -
необхідно мати 500 рослин (культур). З них щомісяця бу-демо отримувати 2500
пагонів, 500 з яких будуть поміщатися в банк, а 2000 - на укорінен-ня.
Недоліком безперервного серійного виробництва є необхідність щомісячного
пере-саджування і поділу культур навіть у періоди падіння попиту на рослини,
оскільки при ліквідації банку рослин відбувається істотне падіння рівня
виробництва і на його відно-влення необхідний час і фінансові ресурси.
Стадія
3. Ризогенез (укорінення) культур. На цій
стадії необхідно створити умови для утворення на пагонах, що надходять із
стадії розмноження адвентивної кореневої системи. Існує два методи укорінення
пагонів:
- метод
А - укорінення в in vitro передбачає пересаджування відділених у фазі
розм-ноження пагонів на нове середовище, основним складником якого є один або
суміш кіль-кох регуляторів росту - ауксинів, які вводяться до складу
середовища. Цитокініни, які використовувалися в середовищах на попередніх
етапах розмноження у цій фазі не засто-совуються - це означає, що у рослинах
проходить зміщення активності ростових процесів - вони перестають галузитися
(пригніується діяльність латеральних меристем), більш ак-тивно розвивається
верхівкова меристема: пагони збільшується в рості і розпочинає утво-рюватися
коренева система.
Висока концентрація агару (більше 1 %) робить середовище твердим, що
негативно впливає на ріст коренів. Тривале перебування пагонів деревних культур
у середовищі з високим вмістом ауксину негативно впливає на коренеутворення. Тому
їх поміщають на середовище з ауксином
лише на 1-3 дні, а далі пересаджують на нове середовище, що його не містить.
Така практика забезпечує добрі результати, проте додає ще одну стадію і вимагає
додаткових витрат на її проведення.
Для успішного перенесення рослин з лабораторії у грунт вони не повинні
мати дуже розвиненої кореневої системи, достатньо того, що коренева система
розпочала утворю-ватися. При утворенні в лабораторії великих коренів на
рослинах їх значно складніше пе-ресаджувати у тепличні контейнери і такі корені
не завжди добре функціонують в ґрунті або на іншому субстраті.
Тривалість перебування рослин на стадії коренеутворення - 2-4 тижні. При
такій сис-темі укорінення, при початку утворення коренів на рослинах в
контрольованих умовах in vitro вони пересаджуються в контейнери з
грунтосумішшю і поміщаються на дорощу-вання і акліматизацію в теплиці
(парники), а далі у відкритий грунт.
- метод Б. Коренеутворення
в лабораторних (контрольованих) умовах in vitro у вели-ких масштабах промислового
виробництва дуже дороге, тому існує
дешевший спосіб - коріння утворюється в умовах теплиці або парників,
тобто мікропагони висаджуються в стаканчики або палетні контейнери і
переносяться в парники або теплиці, де їм створюють умови, аналогічні як і при
укорінення зелених живців. Такий спосіб
має свої переваги: бі-льша швидкість висаджування неукорінених мікроживців ніж
вкорінених; вартість тако-го укорінення
значно нижча, ніж у лабораторії. Проте існує і ряд недоліків такого
способу укорінення.
Не
вкорінені пагони з лабораторії не є цілком сформованими і функціонуючими
рос-линами. Умови зовнішнього середовища під час культивування тканин не
забезпечували достатнього рівня фотосинтезу і рослини були залежними від
наявності вуглеводів у суб-страті, крім того умови високої вологості в умовах in vitro не
сприяють утворенню дос-татнього шару кутикули на листках і тому таким рослинам
складно адаптуватися і вижити в більш сухих умовах, а при збільшенні
інтенсивності освітлення не вкорінені рослини будуть відчувати водний стрес. Тому
для успішного укорінення рослин в умовах парника - теплиці слід створити умови
високої вологості повітря і субстрату, затінити від прямого сонячного світла і
забезпечити помірно теплу температуру. Поганий контроль цих показ-ників у
парнику є основною причиною загибелі рослин, оскільки вони не мо-жуть
залиша-тися живими достатньо довго для того, щоб утворилася коренева система.
Окремою проб-лемою є ураження рослин грибковими хворобами, особливо в умовах
тепла і високої вологості, тому слід дотримуватися рекомендацій по стерилізації
субстрату і проводити захист рослин, застосовуючи хімічні засоби захисту.
Найкращими умовами для укорінення рослин є теплиці з туманоутворюючими
уста-новками. В звичайних теплицях
оправданим є встановлення плівкових тунелей, в які по-міщають рослини на
укорінення. Важливим є те, що в умовах високої вологості виникає ризик
перезволоження субстрату, тому для його приготування обирають компоненти з
ви-соким показником пористості які будуть адсорбувати зайву вологу. Оскільки
для прис-корення укорінення необхідний підвищений вміст ауксину у рослині, то в
субстрат вво-дять порошковидний або рідкий ауксин і замочують в ньому нижню
частину рослини. Ро-биться це під час висаджування живців. Тривалість
укорінення трав'янистих рослин, при забезпеченні оптимальних умов - 3-4 тижні; деревних
культур - дещо більше.
Стадія
4 - акліматизація і дорощування рослин. Після
укорінення
in vitro рослини
пересаджуються у 48 або 64 коміркові палетні контейнери, які заповнюються
пористим субстратом до складу якого дадається незначна частина органічних і
мінеральних добрив, а основна їх частина подається з поливом. При застосуванні
з поливом мінеральних доб-рив дотримуються рекомендацій і застосовують нижні
дози, оскільки дуже легко пере-удобрити субстрат в контейнерах. Рослини витримують
напівзатіненими до повної їх акліматизації і відновлення ефективної
фотосинтетичної діяльності.
Після успішного укорінення відбувається збільшення інтенсивності росту і
утворення нових листків - з цього часу можна поступово збільшувати
інтенсивність освітлення і зни-жувати температуру до значень характерних для
відкритого ґрунту. При доброму рості і розвитку рослин їх переносять на
відкриті площадки на дорощування, реалізують або ви-саджують у шкілку. Всі
зміни умов зовнішнього середовища проводять поступово, оскі-льки різкі зміни
можуть викликати тривалий стрес, ушкодження рослин і навіть їх заги-бель.
5.3. Оздоровлення садивного матеріалу
Розмір експланта для мікроклонального розмноження, його поверхнева
стерилізація, асептичне перенесення на поживне середовище і культивування в
умовах, що виключа-ють інфікування, оздоровлюючи отримані рослини від нематод,
грибкових і більшості бактеріальних патогенів. Однак цього недостатньо для
оздоровлення створеного звичай-ним мікроклональним розмноженням садивного
матеріалу від вірусів, віроїдів, мікоплазм (багато видів рослин соя, цукрові
буряки) передають віруси нащадкам під час
розмно-ження насінням, поступово накопичуючи вірусні інфекції.
Створення безвірусного садивного матеріалу багатьох рослин залишається
актуаль-ним завданням клітинної біотехнології. На сьогодні найефективніший для
досягнення цієї мети засіб - культивування меристем стебла або деяких органів
стеблового походження, які, як правило, вільні від фітопатогенів. Вперше
вільний від вірусних інфекцій садивний матеріал жоржини методом меристемних
культур одержали французи Морель і Мартен у 1952 році. На відміну від грибкових
і бактеріальних хвороб, що порівняно легко можуть бути усунені методом
хіміотерапії, меристемні культури в багатьох випадках є більш на-дійним методом
оздоровлення від вірусів рослин, що вегетативно розмножуються. Він грунтується
на тому, що в інфікованих рослин меристеми розміром близько
У
багатьох випадках для оздоровлення плодових, квіткових, інших корисних видів
рослин від вірусів застосовують мікроклональне розмноження верхівковою
меристемою з одночасною термотерапією - тепловою обробкою при 30-40 °С, яка
знищує фітовіруси. В Нікітському ботанічному саду (Ялта) розроблена модель
системи звільнення рослин від вірусів, яка складається із 6 блоків - методів,
що являють собою єдиний біотехнологічний процес. Основними її елементами є 4
взаємодоповнюючі методи: тестування на віруси ви-хідних рослин, термотерапія
хворих рослин, культивування рослинних тканин і регенера-ція рослин,
ретестування рослин-регенерантів на віруси.
Метод отримання рослин з апікальної меристеми, що складається з конуса
наростан-ня, одного-двох листкових зародків відпрацьований і знайшов широке
практичне впровад-ження.
Можна створити умови і для одержання рослини з тканини тільки конуса
наростання без листкових зачатків. Проте чим більший розмір меристемного
експланту, тобто чим бі-льше листкових зачатків і тканини стебла він має, тим
легше проходить процес морфоге-незу, що закінчується одержанням нормальної
пробіркової рослини. Водночас зона, вільна від одних вірусів, дуже сприятлива
для інших. Дослідженнями встановлено, що після ви-ділення апікальної меристеми
картоплі розміром
|
ДІАГНОСТИКА
І ТЕСТУВАННЯ ВИХІДНИХ РОСЛИН
НА ВІРУСИ (тест-рослини, імунохімічний тест,
електронна мікроскопія) |
|
ТЕРАПІЯ
ВІРУСНИХ РОСЛИН: ТЕРМОТЕРАПІЯ, ХЕМОТЕРАПІЯ (іп vitro або іп vitro, 37°С,
4 - 5 тижнів віроциди) |
|
КУЛЬТУРА ТКАНИН І РЕГЕНЕРАЦІЯ РОСЛИН (14 - 20 тижнів, штучні живильні середовища, 20°С,
освітлення 3,7 - 4,5
клк, фотоперіод 14 - 16
год.) |
|
АДАПТАЦІЯ
РОСЛИН - РЕГЕНЕРАНТІВ ІN VITRO (3 - 4 тижні, 15-20°С, освітлення 3,5-5,0
клк, 12 год., дорощування в теплиці) |
|
РЕТЕСТУВАННЯ АДАПТОВАНИХ
РОСЛИН НА ВІРУСИ (тест-рослини, імунохімічний тест) |
|
СЕРТИФІКАЦІЯ БЕЗВІРУСНИХ
РОСЛИН (суперсупер-еліта, супереліта,
еліта) |
Малюнок 5.3. Схема оздоровлення від вірусів рослин
картоплі
(за Митрофановим і ін., 2000)
Попередня термотерапія вихідних рослин дає змогу оздоровлювати їх від
вірусів за допомогою використання меристемних експлантів розміром 0,3-0,8 мм.
Проте застосу-вання термотерапії у деяких випадках призводить до відставання у
рості і деформації ор-ганів меристемних рослин, посилення латентної вірусної
інфекції. Тому для підвищення ефективності виходу оздоровлених меристемних
рослин використовують хіміотерапію. Останнім часом отримано позитивні
результати у разі введення в живильне середовище, на якому культивують
меристеми, аналога гуанозину - ір-Д-рибофуранозил - 1,2,4 -
триа-золкарбоксаміду. Препарат, що одержав комерційну назву "віразол"
(синтетичний рибаві-рин), введений до живильного середовища в концентрації 40 -
Оздоровлені із застосуванням меристемної культури рослини в подальшому
розмно-жують звичайним методом мікроклонального розмноження. Винятком є техніка
мікро-щеплення, яку застосовують для оздоровлення цитрусових рослин, персиків і
яблуні. Для них потреба у застосуванні цієї техніки пов'язана із слабким
ефектом у разі використання меристем маленького розміру. Кращих результатів
досягають у разі щеплення меристеми лимонів і апельсинів розміром 0,14-0,18 мм
на пробіркові підщепи, отримані з насіння. Можна одержати 30-50% успішних
щеплень, 95% щеплених рослин зберігається при виса-джуванні у грунт. Із семи
вірусів, найбільш поширених у цитрусових, для п'ятьох оздоровлення
спостерігали на рівні 100% щеплених рослин, для двох - 80-98 відсотків.
Застосування біотехнологічних методів розмноження у розсадництві плодових
рослин дозволяє підвищити ефективність оздоровлення рослин, в 5-10 і більше
разів, збільшити коефіцієнт розмноження в 50-100 разів скоротити виробничі
площі, на 2-3 роки приско-рити впровадження нових сортів і підщеп у промислове виробництво.
Для оздоровлення і розмноження слаборослих
підщеп яблуні (МБ, 57-195, 57- 491, 62-396 та ін) необхідно підбирати добре
розвинені і укорінені відсадки підщеп без поперед-нього їх вирощування у
горшках. Найбільш ефективно проводити термотерапію яблуні відразу після
закінчення фази глибокого спокою (січень-лютий). Вихідними тканинами для
мікророзмноження є апікальні і латеральні бруньки з верхівки.
Поверхневу стерилізацію проводять розчином нітрату срібла, сулеми або
відбілюва-чем „Білизна". Кращі результати
отримані при витримці протягом 1 хв. у розчині нітрату срібла і сулеми, 5
хвилин у розчині „Білизни".
6.4. Практичне значення методу мікроклонального
розмноження
Метод мікроклонального розмноження відкриває широкі можливості стосовно прис-корення
селекційного процесу, тривалого підтримання і зберігання цінних генотипів, а
та-кож розширення можливостей мутагенезу, розхимерювання тканин і добору цінних
мута-нтних форм в умовах in
vitro. Використання мутаційних змін - визнаний
метод селекції ро-слин, що вегетативно розмножуються, а використання
мікроклонального розмноження ме-тодом прямого органогенезу з цілих експлантів є
надійним методом реалізації бажаних ге-нетичних змін у рослин в порівнянні з
традиційними.
Мікроклональне розмноження використовується для вирішення низки
селекційних завдань:
-
у багатьох видів рослин (капусти, моркви, буряків, томатів тощо) комерційне
значен-ня мають лише гібриди 1-го покоління (F1);
виробництво гібридного насіння, а також під-тримування вихідних батьківських
форм, представлених самозапилюваними лініями (час-то самонесумісними) є
трудомістким, а застосування методу мікроклонального розмно-ження вирішують ці
проблеми;
-
одержання гібридів (F1);
сільськогосподарських культур часто ґрунтується на вико-ристанні
цитоплазматичної чоловічої стерильності (ЦЧС); підтримання генотипів з цією
ознакою пов'язане з тривалим процесом зворотних схрещувань (беккросуванням); у
дея-ких випадках потрібно мати лінії-відновники ЦЧС, що також пов'язано із серією
схрещу-вань і послідовного добору чоловічо стерильних форм серед гібридних
комбінацій. Якщо немає генетичних маркерів, то добір генотипів із ЦЧС проводять
на рослинах у період їх цвітіння. Такий добір особливо тривалий у рослин із
цитоплазматичною чоловічою сте-рильністю, зумовленою ядерними чинниками. У
деяких видів (цибулі, цукрових буря-ків тощо) такі стерильні форми можна
підтримувати методами мікроклонального розмно-ження in vitro. Цей
метод рекомендований для виробництва, наприклад, гібридного насін-ня томатів.
Розмноження гібридних рослин методом одержання мікроклонів в умовах in vitro
є
економічно вигідним порівняно з гібридами ручного запилення.
Культуру тканин можна використовувати для клонового розмноження
дводомних видів, зокрема для відібраних генотипів, які застосовують як
батьківські форми для одер-жання великої кількості насіння.
Мікророзмноження деяких гетерозисних генотипів у великій кількості, що
можуть бу-ти використані як вихідні батьківські форми у гетерозисній селекції,
можливе у видів, що традиційними методами розмножуються дуже повільно (цибуля,
диплоїдні і тетраплоїдні цукрові буряки).
Мутантні рослини, отримані іп vitro можна клонувати у культурі тканин.
Альбіноси і біохімічні мутанти, придатні для клітинної селекції, соматичної
гібридизації, а також для перенесення генів і хромосом, можуть підтримуватися іn vitro, тоді
як у звичайних умовах вони нежиттєздатні.
Для деяких видів рослин застосування традиційних методів селекції
ускладнене через тривалість життєвого циклу, високий рівень гетерозиготності,
труднощі статевого розмно-ження. Тому можливість клонування таких генотипів іп
vitro значно полегшує їх селекцію і розмноження.
Типовим прикладом є мікроклональне розмноження цінних генотипів па-льми в
умовах селекції на підвищений вміст олії.
Технології мікророзмноження постійно вдосконалюються проте їх основні
недоліки - значна трудоємність і високі витрати. Проте для автоматизації і
взагалі для зменшення затрат праці, матеріалів, енергії та інших ресурсів
потрібна розробка принципово нових прийомів: застосування техніки гідро- та
аеропоніки іп vitro, регуляцію і стимулювання процесів
морфогенезу короткими світловими імпульсами різного спектрального складу;
застосу-вання полімерів, що регулюють водопостачання рослини відповідно до
потреби. Підвищення рентабельності виробництва клонально розмноженого,
оздоровленого матері-алу іп vitro
має
ресурси в збільшенні коефіцієнта розмноження, відсотка укорінених мік-роклонів,
швидкості роботи операторів. Надалі прогрес пов'язаний з автоматизацією і
ро-ботизацією трудомістких процедур. В структурі собівартості оплата праці,
навіть у рен-табельних виробництвах, становить 41% загальних витрат. Перехід до
автоматизації мож-ливий за розуміння, що розмножуваний матеріал - це майбутня
рослина стандартних роз-мірів, форм, кольору яку може розпізнати електроніка
автоматично при виконанні заданої програми. Технології вирощування меристем,
мікроклонів у суспензіях, рідкому живиль-ному середовищі автоматизуються легше.
Перспективними є технології використання соматичного ембріоїдогенезу для
одер-жання штучного насіння, які проводять у багатьох лабораторіях світу.
Невирішених біологічних і технічних проблем багато, одна з них -
створення моду-люючих умов, за яких соматичні ембріоїди не будуть або, навпаки,
будуть мати генетичні варіації порівняно з прототипом.
Останнім часом розробляються і удосконалюються не лише методи одержання
штуч-ного насіння із соматичних ембріоїдів, які широко застосовуються в
промисловості для багатьох сільськогосподарських культур, але й альтернативні
шляхи прискореного кло-нального розмноження елітного матеріалу, зокрема
капсулювання верхівкової меристеми. Технологія прискореного розмноження полягає
в тому, що верхівки пагонів близько
У
біотехнологіях для потреб сільського господарства багато емпірики. Необхідно
об'є-днати знання, отримані на основі молекулярної генетики і генної інженерії,
із знаннями фізіологів рослин про регуляцію процесів росту і розвитку вищих
рослин на рівні клітин, тканин, органів. Тільки така інтеграція зусиль може
привести до створення принципово нових, ефективних і рентабельних клітинних
технологій, що вже використовуються для вирішення проблем сільського
господарства.