Тема 5. КУЛЬТУРИ РОСЛИННИХ
КЛІТИН
План:
5.1.
Культури клітин вищих рослин
5.2.
Культури соматичних клітин
5.3.
Морфофізіологічна характеристика калусних тканин
5.4.
Суспензійні культури
5.5.
Культивування окремих клітин
5.6. Культури
гаплоїдних клітин
5.7. Нові
експериментальні системи для вивчення синтезу вторинних метаболітів з використанням культури тканин рослин
5.8. Протопласти рослинних клітин як об'єкт
біологічного конструювання.
5.9.
Конструювання клітин
5.1. Культури
клітин вищих рослин
В основi клiтинної iнженерiї лежить гiбридизацiя
соматичних клiтин - злиття неста-тевих клiтин з утворенням єдиного цiлого. Вона
може бути повною або придбати окремi частини клiтини-донора: цитоплазму,
мiтохондрiї, хлоропласти, ядерний геном або його
бло-ки. Культури клітин вищих рослин мають дві сфери застосування:
- вивчення біології клітини, що існує поза організмом,
обумовлює провідну роль клі-тинних культур у фундаментальних дослідженнях по
генетиці і фізіології, молекулярній біо-логії і цитології рослин. Популяціям
рослинних клітин властиві специфічні особливості: генетичні, епігенетичні
(залежні від диференційованої активності генів) і фізіологічні. При тривалому
культивуванні гетерогенної по цих ознаках популяції відбувається розмноження
клітин, фенотип і генотип яких відповідає умовам вирощування, отже, популяція
еволюціо-нує. Все це дозволяє вважати, що культури клітин є новою
експериментально створеною біологічною системою, особливості якої поки що мало
вивчені. Культури клітин і тканин можуть бути адекватною моделлю при вивченні
метаболізму і його регуляції в клітинах і тканинах цілої рослини;
- культивовані клітини вищих рослин можуть розглядатися як
типові мікрооб'єкти, достатньо прості в культурі, що дозволяє застосовувати до
них не тільки апаратуру і техно-логію, але і логіку експериментів, прийнятих в
мікробіології. Разом з тим, культивовані клітини здатні перейти до програми
розвитку, при якій із культивованої соматичної клітини виникає ціла рослина,
здатна до росту і розмноження. Існує декілька напрямків створення нових
технологій на основі культивованих тканин і клітин рослин:
- отримання біологічно активних речовин рослинного
походження;
- традиційних продуктів вторинного метаболізму
(токсинів, гербіцидів, регуляторів рос-ту, алкалоїдів, стероїдів, терпеноїдів,
що мають медичне застосування);
- синтез нових сполук, що можливо завдяки
початковій неоднорідності клітинної попу-ляції, генетичній мінливості
культивованих клітин і селективному відбору клітинних ліній із стійкими
модифікаціями, а в деяких випадках і направленому
мутагенезу;
- культивовані в суспензії клітини
можуть застосовуватися як мультиферментні систе-ми, здатні до широкого спектру
біотрансформацій хімічних речовин (реакції окислення, від-новлення,
гідроксилювання, метилування, деметилування, гліколізування, ізомеризації). В
результаті біотрансформації отримують унікальні біологічно активні продукти на
основі син-тетичних з'єднань або речовин проміжного обміну рослин інших видів;
- прискорене клональне мікророзмноження рослин, що дозволяє
з одного екпланта
от-римувати від 10 000 до 1 000 000 рослин в рік, причому всі вони будуть
генетично ідентичні;
- отримання безвірусних
рослин;
- ембріокультура і запліднення in vitro часто застосовуються для подолання
статевої не-сумісності або недорозвиненості зародка, для отримання рослин після
віддаленої гібриди-зації. При цьому запліднена яйцеклітина видаляється із
зав'язі з невеликою частиною ткани-ни перикарпа
і
переноситься на поживне середовище. У таких культурах можна спостерігати і стадії розвитку зародка;
Тканинні культури – культури
пильовиків і пилку використовуються для отримання гап-лоїдів і дигаплоїдів:
- клітинний мутагенез і селекція. Тканинні культури можуть
проводити регенеранти, фенотипічні і генотипічні що відрізняються від
початкового матеріалу в результаті сомакло-нального варіювання. При цьому в
деяких випадках можна обійтися без мутагенної обробки;
- кріоконсервація і інші методи збереження генофонду;
- іммобілізація рослинних клітин;
- соматична гібридизація на основі злиття рослинних протопластів;
- конструювання клітин шляхом введення різних клітинних органел;
- генетична трансформація на хромосомному і генному рівнях;
- вивчення системи «господар-паразит» з використанням
вірусів, бактерій, грибів, ко-мах.
5.2. Культури соматичних клітин
В основі культивування рослинних клітин лежить властивість
тотипотентності, завдяки якій соматичні клітини рослини здатні повністю
реалізовувати спадкову інформацію, тобто забезпечити розвиток всієї рослини,
оскільки на відміну від тваринної, рослинна клітина менш вимоглива до умов культивування.
Основним типом культивованої рослинної клітини є калус. Калусна тканина - один із видів
клітинного поділу, яка виникає в результаті неорганізованої проліферації
диференційо-ваних клітин органів рослини.
Вона захищає місце поранения, може
накопичувати поживні речовини для анатомічної регенерації або регенерації
втраченого органу.
Процесу утворення калусу передує диференціація тканин експлана, в результаті якої втрачається
структура, характерна для перебігу специфічних функцій в рослині, і повернення
до стану клітин, що діляться. Якщо експлант є фрагментом органу, то він в
своєму складі має епідермальні клітини, клітини камбію, судинної системи,
серцевину і первинну паренхіму. Переважно діляться клітини камбію та
серцевинної паренхіми.
Різне походження тканин калусних клітин є однією з
причин гетерогенності калусної тканини, оскільки деякі функціональні
особливості початкових клітин передаються у ряді клітинних поколінь як стійкі
модифікації.
5.3. Морфофізіологічна
характеристика калусних
тканин
В біотехнології виділяють два типи культивованих рослинних калусних
клітин: норма-льні і пухлинні.
Нормальні клітини в
культурі можуть існувати в двох видах: у вигляді суспензії на рід-кому
поживному середовищі і на поверхні твердого поживного середовища у вигляді
калусу. Поверхневе культивування проводиться в напіврідкому агаризованому середовищі, на дис-ках з
поліуретану, на містках з фільтрувального паперу, напівзанурених в рідке
поживне середовище. Придатні для цих цілей і вата, оброблена поживним
середовищем, які зверху покриваються фільтрувальною бумагою, фольгою.
Пухлинні клітини
морфологічно мало відрізняються від калусних. Фізіологічною від-мінністю є
гормононезалежність пухлинних клітин. Завдяки цій властивості вони діляться і
ростуть на поживних середовищах без фітогормонів та позбавлені здатності
започаткувати нормально організовані структури (коріння, пагони) в процесі
органогенезу, іноді утворюють тератоми (потворні органоподібні структури), подальший
розвиток яких неможливий.
Калусна тканина, що вирощується поверхневим способом, є
аморфною масою тонко-стінних паренхімних клітин, що не має чіткої анатомічної
структури. Колір маси може бути білим, жовтуватим, зеленим, червоним. Залежно
від походження і умов вирощування калусні
тканини бувають:
- рихлі, сильно обводнені, що легко розпадаються на окремі
клітини;
- середньої щільності, з добре вираженими меристематичними осередками;
- щільні, із зонами зредукованого камбію і судин.
Ріст калусної тканини, характеризується трьома типами
клітин: дрібними, середніми і великими. При пасажуванні тканини на середовище,
що містить індуктори органогенезу, дрібні клітини діляться, формуючи
меристематичні вогнища, які започатковують утворення бруньок з подальшим
розвитком пагонів (гемогенез), або до процесу ризогенезу.
Клітини меристеми ранніх стадій розвитку відрізняються від
калусних високим вмістом РНК і білку. При культивуванні соматичних ембріоїдів
калусна клітина середніх розмірів відособлюється, обмежується щільною
оболонкою, втрачаючи крупні вакуолі. Вона містить велике структуроване ядро з
ядерцем. Клітина ділиться мітотично, внаслідок чого виникають 2 клітини
проембріо. Наступне ділення клітин призводить до формування зародка, а також органу, аналогічного
суспензорам в зародковому мішку сім'ябруньки. Подальший розвиток соматичного
ембріона через ряд стадій призводить до регенерації цілої рослини із корінням і
погонами, оскільки в цьому випадку формується біполярна структура.
Калуси з високим морфогенетичним потенціалом зазвичай
матові, компактні, структу-ровані, мають зелені хлорофілвмісні
ділянки, які є зонами морфогенезу. Згодом там форму-ються пагони або рослини - регенеранти. У
культурі зустрічаються і калуси
рихлі, які не мають глобулярного характеру. Такі калуси або зовсім не здатні до органогенезу,
або фор-мують тільки коріння. Поява коріння свідчить про зрушення гормонального
балансу в бік ауксинів, що перешкоджає утворенню пагонів. Ці калуси можуть залишатися ризогенними, і
регенерувати з них рослини не вдається. Неморфогенні калуси можуть бути переведені в сус-пензійну
культуру для отримання вторинних метаболітів.
Перехід спеціалізованих клітин, що не діляться, до
проліферації пов'язаний з їх дифе-ренціацією
(втратою спеціалізації). В основі такого процесу, як і при диференціації клітин
в рослині, лежить диференціальна активність генів, які визначають структуру і
функції клітин, тобто спеціалізацію різних генів в різних клітинах.
Виникнення фізіологічних і структурних відмінностей між
клітинами і тканинами рос-лин, пов'язане з їх функціональною спеціалізацією,
називають процесом диференціації. По-няття «диференціація» відображає
перетворення ембріональної, меристематичної клітини в спеціалізовану.
Меристематичні клітини, однотипні по структурі і функції, розвиваються різ-ними
шляхами, створюючи тканини різних органів. Між геномами в клітинах, які
набувають різної форми і функції, відсутні якісні відмінності, і ці клітини
розрізняються тільки внаслі-док різної експресії генів. Новостворена клітина
володіє широкими потенційними можливос-тями і може розвиватися самостійно,
як морфологічно так і фізіологічно.
Визначення напрямку
розвитку кожної клітини є основою фізіології її розвитку і визна-чається
особливим набором білків (кожна спеціалізована клітина виробляє тільки їй
властиві білки, що є наслідком диференціальної активності генів - експресії
однієї групи генів при одночасній репресії інших). Здатність єдиної зрілої
соматичної клітини дати початок цілому організму вказує на те, що в процесі
нормальної клітинної диференціації у рослин не відбу-вається втрати або
незворотньої інактивації генів.
У рослин майже всяка диференціація зворотня за умови, якщо
диференційована клітина жива, в протопласті
збереглося ядро і не утворилася вторинна оболонка. За певних умовах багато зрілих рослинних
клітин зберігає здатність ділитися, а в деяких випадках і вступити на новий
шлях розвитку.
Таким чином, після ділення перед кожною дочірньою клітиною
відкривається одна із трьох варіантів: клітина може залишатися ембріональною і
повторно вступати в клітинний цикл з подальшим мітозом; може опинитися як би
«поза циклом» (Go),
переставши ділитися; поступово детермінуватися та вступати на шлях
диференціювання (спеціалізації).
Компетенція - здатність клітини сприймати
індукуючу дію і специфічно реагувати змі-ною розвитку. Індукуючу дію можуть
створювати: гормони, продукти життєдіяльності сусід-ніх клітин, інших тканин,
електрофізіологічні сигнали.
Детермінація -
придбання клітиною стану готовності до реалізації певних спадкових
властивостей. Вона може розпочатися відразу ж після ділення на початку
утворення протоп-лазми. Детермінована певним чином клітина набуває вузької
спеціалізації, тобто диференці-юється і перетворюється на клітину якої-небудь
тканини. З гормональних факторів диферен-ціації і морфогенезу клітин першорядна
роль відводиться ауксинам і цитокінінам.
Клітина, введена в культуру, зазнає послідовні зміни:
перехід до диференційованого стану, ембріонального росту і, завдяки здатності
калусу до вторинної диференціації, формо-утворення. Взаємодія між клітинами
виступає як вирішальний чинник їх диференціації і спеціалізації. Процес диференціації
клітин обумовлений різним ступенем репресії і дерепре-сії генетичної
інформації.
У асоціації клітин калусної тканини одні клітини займають
певне положення і за допо-могою фізико-хімічних контактів впливають на інші,
чим визначається їх структурно-функ-ціональний стан. Міжклітинні взаємодії
відбуваються за допомогою відповідних донорно-акцепторних молекул мембрани
цитоплазми, якими можуть бути низькомолекулярні білки, комплекси вуглеводів з
білками, фітогормони, інгібітори, полярні з'єднання та інші. Але у всіх
випадках на основі нуклеїново-білкового, білково-вуглеводного і іншого типу
функціо-нування вони сприятимуть злипанню або відштовхуванню клітин,
виступатимуть як ефек-тори або апорепресори. У клітині реципієнта за допомогою
спеціальних рецепторів такі мо-лекули зв'язуватимуться і змінюватимуть в
епігенезі реакцію генетичної інформації. Таким чином, в основі диференціації
клітин лежать процеси репрограмування, репресії, дерепресії генетичної
інформації, які призводять до утворення спеціалізованих клітин, що стають
здат-ними до взаємодії, асоціації, утворення геометричних форм, до органо- і
морфогенезу.
5.4. Суспензійні культури
Суспензійні
культури - окремі клітини або групи клітин, що зависло вирощуються в рід-кому
середовищі і є відносно гомогенною популяцією клітин, яку легко піддавати
впливу хімічних речовин. Вони широко використовуються як модельні системи для
вивчення шляхів вторинного метаболізму, індукції ферментів і експресії генів,
деградації чужорідних з'єднань, цитологічних досліджень… .
Ознакою "доброї" лінії є здатність клітин до
перебудови метаболізму і висока швидкі-сть розмноження в конкретних умовах
культивування. Морфологічні характеристики такої лінії:
- високий ступінь дезагрегації (5-10 клітин в групі);
- морфологічна вирівненість клітин (невеликі розміри, сферична або овальна
форма, щільна цитоплазма);
- відсутність трахеїдоподібних елементів.
Клітинну суспензію отримують, поміщаючи калусну тканину в колбу із рідким пожив-ним середовищем.
Суспензія перемішується в колбі на гойдалці, зі швидкістю 100-120 об/хвилину.
При першому перенесенні на свіже середовище видаляють крупні шматочки
по-чаткового калусу і крупні агрегати, фільтруючи через 1-2 шару марлі,
нейлонові сита, шприц з відповідним отвором. Для ініціалізації суспензійної
культури необхідно 2-3 г свіжої маси калусної
культури на 60-100 мл
рідкого поживного середовища. Для кожної лінії культури клітин існує
мінімальний об'єм інокулята, при
меншому розмірі якого культура не росте.
Для глибинного культивування рослинних клітин розроблені
два види систем культи-вування: відкриту і закриту.
Для закритої системи
характерний періодичний режим вирощування. Клітинна маса (інокулят) переноситься в певний об'єм середовища.
Система закрита по всіх параметрах, ок-рім газів, до кінця вирощування.
Періодично подається свіже поживне середовище, а стара віддаляється в тому ж
об'ємі. Клітини залишаються в системі протягом всього циклу вирощу-вання. Це
найбільш вивчене і поширене культивування.
Відкриті (проточні)
культури характеризуються надходженням свіжого поживного се-редовища, при якому
видаляється не тільки старе поживне середовище, але і частина вироб-леної
клітинної маси.
Відмінна особливість суспензійних культур клітини рослин - висока
щільність, необхід-на для нормального росту. Тому важливим, при культивуванні
клітин рослин, є збільшення її в'язкості та створення умов для росту біомаси,
яке призводить до адгезії (прилипання клітин один до одного, на поверхнях
культуральної ємності). У верхній частині посудини поступово може утворюватися
піна, що складається з білків, які виділяються клітинами, і поліцукрами. В
процесі культивування клітини злипаються і частина з них скупчується в піні,
утворюючи «кірку», або «безе». Із збільшенням біомаси клітин збільшується і
«кірка», знижуючи інтен-сивність перемішування, що врешті-решт може загубити
культуру.
Клітини рослин володіють меншою фізіологічною і
метаболічною активністю в порів-нянні із мікроорганізмами. Час генерації
(інтервал часу між двома послідовними клітинними діленнями) рослинної клітини в
60-100 разів перевищує час генерації мікробної клітини. Пул проліферуючих
клітин не перевищує 50-60%, багато з яких призупиняють ділення і перехо-дять у
фазу спокою.
Всі ці обставини визначають тривалий ріст популяції клітин
при накопичувальному, або періодичному, вирощуванні. Підтримка стерильності
протягом тривалого часу є однією з технічних проблем, особливо при
безперервному культивуванні.
Періодичне, або накопичувальне, культивування - це
найпростіший спосіб вирощуван-ня
клітин поки є традиційним. Суспензійні культури використовують для промислового
от-римання вторинних метаболітів.
Речовини, що продукуються рослинними клітинами вико-ристовуються в медицині,
парфюмерній промисловості, рослинництві і інших галузях про-мисловості. До них
відносяться: алкалоїди, терпеноїди, глікозиди, поліфеноли, поліцукри, ефірні
масла, пігменти, антикарцерогени (птотецин, харингтонін), пептиди (інгібітори
фіто-вірусів). В даний час використовується близько ста видів рослин в
біосинтетичній промисло-вості для отримання економічно важливих речовин, серед
яких - женьшень, раувольфія змії-на, наперстянка шерстиста і пурпурна,
діоскорея дельтовидна, воробейник, беладона, паслін часточковий, дурман
звичайний, конвалія травнева, рецина, агава, мак снодійний і ін.
Отримання вторинних метаболітів має
свої особливості. Ділення клітин, що призводить до збільшення клітинної
біомаси, і синтезу вторинних метаболітів роз'єднані в часі. Накопи-чення
вторинних метаболітів зростає у фазі сповільненого росту клітинної популяції і
сягає максимуму в стаціонарній фазі. Деякі алкалоїди активно синтезуються у
фазі максимальної мітотичної активності (експотенціальне зростання), що є
виключенням. Знання таких законо-мірностей дозволяє регулювати процеси
отримання цінних речовин. Механізми і умови, бло-куючи активний ріст клітин і
клітинну проліферацію, одночасно активують ферменти вто-ринного метаболізму.
Неспецифічні стресові умови, що впливають на клітини в кінці експо-тенціальної
фази, можуть стимулювати перехід до синтезу вторинних метаболітів і
збіль-шувати їх вихід.
5.5. Культивування окремих клітин
Окремі клітини культивують для отримання клонів, вивчення
їх генетичної і фізіоло-гічної мінливості або стабільності. Крім того, культивування
окремих клітин дозволяє вив-чати умови, що визначають виникнення стимулів до
ділення у клітин, ізольованих від впливу інших клітин популяції або тканин.
Окремі клітини важливі і для клонової селекції, гібрид-них і трансформованих
ліній мутантів. Зазвичай, в такі клітини вводять маркерні гени, які дозволяють
запроваджувати селекційні методи виведення нових сортів сільськогосподар-ських
культур.
Крім того, окремі клітини можуть бути моделлю для
порівняльного вивчення фізіоло-гічних процесів в тканині і ізольованій клітині
(для вивчення фотодихання можна порівню-вати процес фотосинтезу на рівні
окремих клітин мезофіла листка і цілої тканини).
Вирощування ізольованих клітин складається з двох етапів:
ізолювання непошкодженої клітини рослинної або калусної тканини; створення
умов, сприятливих для росту і розвитку ізольованої клітини.
На першому етапі необхідно виділити непошкоджену і
життєздатну клітину з тканини цілої рослини або калусної тканини. Цього можна
досягти шляхом обробки тканини пектина-зами, що сприяє мацерації її клітин.
Проте не завжди після такої обробки клітини зберігають здатність до подальших
ділень і утворення тканини. Краще отримувати окремі клітини із суспензійних
культур або рихлого калусу. Ідеальними окремими клітинами є протопласти, що
утворили клітинну стінку. Потім клітини ізолюють мікроманіпуляторами, або
шляхом послідовних розведень. При перших же спробах культивування окремих
клітин виникла проблема: як змусити ділитися клітини, ізольовані від впливу
інших клітин популяції або тканин? Окремі клітини поводилися інакше, ніж їх
скупчення у вигляді агрегатів в суспензії або калусній масі на поверхні
поживного середовища.
При її вирішенні виникла гіпотеза про «фактор кондиціонування»
(так було названо ре-човину, стимулюючу ділення окремих клітин). Встановлено,
що цей чинник має хімічну при-роду, термолабілен, водорозчинний,
низькомолекулярний, видонеспецифічний, не заміняє ві-домі фітогормони,
синергічний із брассиностероїдами.
Вперше підібрати умови, відповідні для ділення окремих
клітин, вдалося в 1954 році Мьюїру, Хильденбранту і Райкеру. Цей спосіб отримав
назву методу «тканини - няньки» (мал.
5.1).
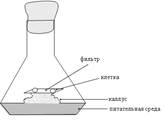
Малюнок 5.1.
Схема використання калусу як «тканина - нянька»
Клітину ізолюють за допомогою мікроманіпулятора з
рихлого калусу безпосередньо на шматочок фільтру розміром 8 х
Інший метод «годуючого шару» полягає в тому, що
використовують суспензію клітин того ж виду, що і певна клітина близького виду.
Клітинна суспензія повинна знаходитися в ранній експоненціальній фазі росту. У
1959 році Бергман запропонував фільтрувати суспен-зійну культуру (у його
експериментах це були тютюн і квасоля) стерильно через один шар батисту (0,3 х
Індукція ділень окремих клітин можлива при застосуванні
дуже багатого поживного середовища (середовища Као і Михайлюка). При цьому
об'єм середовища, в яке переносять клітини, повинен бути мінімальним
(мікрокраплі об'ємом до 20 мкл).
Всі ці способи культивування дозволяють клітині «відчувати»
фактор кондиціонування. Він або виробляється в достатній кількості клітинами
«годуючого шару», «тканини – нянь-ки», або міститься в суспензії, де раніше
культивувалися клітини, або розбавляється у вели-кому об'ємі середовища.
Таким чином, фактор, що викликає ділення клітин,
виробляється самими клітинами, але в невеликій кількості. Збільшувати число
клітин, що його виробляють можна до тих пір, по-ки він не розбавляється у
великих об'ємах поживного середовища, або ж зменшувати його об'єм, в якому
вирощуватиметься клітина, змусивши її
ділитися.
5.6. Культури гаплоїдних клітин
Значний інтерес для селекціонерів представляють гаплоїдні
рослини, які отримують двома способами:
- перший спосіб класичний - віддалена гібридизація, коли в
зиготі віддаленого гібриду хромосоми одного з видів елімінують.
- другий - заснований на методиках культивування in vitro, де з
незапліднених статевих клітин із зредукованим набором хромосом можна
регенерувати цілі рослини. Зазвичай вони стерильні, оскільки у них порушено
формування чоловічих і жіночих гамет. При
культиву-ванні in vitro, може відбутися спонтанне
подвоєння хромосом, або його можна викликати штучно, наприклад, обробивши
колхіцином клітини або рослини. Дигаплоїди фертильні і цілком життєздатні.
Гаплоїди і дигаплоїди мають ряд переваг в селекційній
роботі:
- гаплоїдні рослини мають один набір хромосом, характерний
для гамет, що дає селек-ціонерам можливість спостерігати мутації відразу ж в
ході огляду гаплоїдних рослин, оскіль-ки всі рецесивні генні мутації в
гаплоїдних організмах не маскуються домінантними алеля-ми;
- якщо гаплоїдні клітини піддати поліплоїдизації за
допомогою колхіцину, то виник-нуть дигаплоїди, що характеризуються абсолютною
гомозиготністю. Схрещування гомози-готних ліній дає, як правило,
високопродуктивне потомство;
- гомозиготні рослини використовуються селекціонерами і в
інших цілях: кількісний генетичний аналіз, вивчення взаємодії генів, вивчення
генетичної мінливості, визначення груп зчеплення, встановлення числа генів, що
діють на кількісні ознаки, визначення локалі-зації полігенів і так далі;
- гаплоїдні рослини позбавлені летальних або сублетальних
мутацій, які призводять до загибелі або ослаблення потомства.
Гаплоїди вищих рослин можна отримати із експлантів,
взятих на будь-якій стадії роз-витку гаметофіта після
редукційного ділення клітин спорогенної тканини пилку.
Найбільш поширені наступні методи індукції гаплоїдів:
- індукований андрогенез в
культурі пилку;
- селективна елімінація хромосом в гібридному зародку
(найчастіше використовується в селекції злакових);
- псевдогамія - розвиток гаплоїдного зародка після
запліднення чужорідним пилком без запліднення яйцеклітини, або ж розвиток
ізольованої сім'ябруньки (гіногенез).
Культура пилку є культивуванням мікроспор, звільнених від
соматичних тканин пилку, в рідкому середовищі. Пилок від соматичної тканини
відокремлюють декількома способами:
- спонтанне вивільнення (пасивний спосіб) - пилок певним
чином обробляється, інкубу-ється на рідкому середовищі, вивільняється і спливає;
- гомогенізація і фільтрація. Пилок, що культивується в
рідкому середовищі, руйнують, надрізаючи скальпелем і обережно натискаючи
фільтрують (пори фільтру 50-100 мкм) і цен-трифугують. Осад промивають і
суспендують в рідкому середовищі;
- розрізання - розрізають стінку пилку. Цей метод
застосовується рідко, оскільки трудо-місткий і тривалий.
Пилковий ембріогенез обумовлений функціональною і
структурною детерміацією пил-кового ядра і клітин гаметофіту, тому в розвитку
можуть брати участь: вегетативні клітини; генеративні клітини; обидва типи
клітин, якщо вегетативні і генеративні клітини зіллються, при цьому утворюється
диплоїдний ембріоїд. Для пасльонових характерний тільки ембріоге-нез, для
злакових - утворення калусів і ембріоїдів. Серед гаплоїдів багато альбіносів (особли-во
у злаків). Найбільший вихід регенерантів-альбіносів в культурі пилку, що
викликане, по-рушеннями розвитку пилку.
При віддаленій гібридизації деяких видів, встановлено явище
селективної елімінації хромосом одного із батьків на ранній стадії розвитку
гібридного зародка. Залежно від того, яка клітина зародку дасть початок новому
організму, розрізняють партеногенез і апогамію.
Партеногенез –
розвиток яйцеклітини без запліднення. При апогамії зародок розвиває-ться із
синергіди або антиподи.
Гіногенез може
відбуватися двома шляхами - через ембріогенез і через калусогенез.
5.7. Нові
експериментальні системи для вивчення синтезу вторинних метаболітів з використанням
культури тканин рослин
Іммобілізація
рослинних клітин: необхідність, основні методи. Культури
клітин і тканин рослин вважаються потенційним джерелом специфічних вторинних метаболітів, до яких від-носяться такі сполуки, як
алкалоїди, стероїди, масла і пігменти. Отримують їх шляхом екст-ракції із
рослин, проте не до всіх видів рослин дані методи мікробіологічної
промисловості є прийнятними.
Новим підходом, спрямованим на збільшення виходу вторинних
метаболітів, є іммобі-лізація клітин і тканин рослин. Основні її методи поділяють на 4 категорії:
- іммобілізація клітин або субклітинної органели в
інертному субстраті. Метод припус-кає обволікання клітин одного з цементуючих середовищ - альгінат, агар,
колаген, поліак-риламід;
- адсорбція клітин на інертному субстраті. Клітини
прилипають до заряджених кульок з альгінату, полістиролу, поліакриламіду;
- адсорбція клітин на інертному субстраті за допомогою
біологічних макромолекул (лектин). Застосовується рідко;
- ковалентне з’єднання із іншим інертним носієм типу КМЦ застосовується
дуже рідко. Останнім часом інтерес до іммобілізації клітин рослин значно зріс,
оскільки іммобілізовані клітини мають певні переваги перед калусними і
суспензійними культурами при викорис-танні їх для отримання вторинних
метаболітів.
Фізіологічні основи переваги іммобілізованих рослинних
клітин перед традиційними способами культивування. Результати
наукових досліджень вказують на те, що існує пози-тивна кореляція між
накопиченням вторинних метаболітів і ступенем диференціації в куль-турі клітин.
Отримані дані свідчать, що диференціація і накопичення вторинних продуктів
обміну речовин відбувається в кінці клітинного циклу. При зниженні росту клітин
процеси диференціації прискорюються.
Наявність організованості в тканині і її подальший вплив на
фізичні і хімічні інградієн-ти - чіткі показники, по яких розрізняються високо-
і низкопродуктивні культури. Очевидно, що іммобілізація клітин забезпечує
умови, що призводять до диференціації, упорядковує організацію клітин і сприяє
високому виходу вторинних метаболітів.
У рослині будь-яка клітина оточена іншими клітинами, але її
положення змінюється в ході онтогенезу в результаті ділення як її так і
навколишніх клітин. Від положення клітини в рослині залежить ступінь і тип її
диференціації, впливаючи на її метаболізм. Регуляція син-тезу вторинних
метаболітів знаходиться як під генетичним, так і під епігенетичним
(позая-дерним) контролем, тобто будь-які зміни в цитоплазмі можуть призвести до
кількісних і якіс-них змін в утворенні вторинних метаболітів. У свою чергу,
цитоплазма є динамічною систе-мою, що знаходиться під впливом навколишнього
середовища. Із зовнішніх умов на мета-болізм істотний вплив справляє:
концентрація кисню і вуглекислого газу, а також рівень ос-вітлення.
Таким чином,
вторинний метаболізм в крупних агрегатах клітин з невеликим відно-шенням площі
до об'єму (S/V) відрізняється від ізольованих і дрібних груп клітин в
резуль-таті дії градієнтів концентрації газів.
Існує 2 типи систем
культивування іммобілізованих клітин:
- система культури із плоскою основою, клітини вирощуються
в горизонтально розта-шованій ємкості (мал.
5.2);
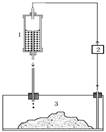
Малюнок 5.2. Система культивування імобілізованих
клітин з плоскою основою
-
система колоночної
культури, де клітини вирощуються у вертикальній ємкості.
В обох системах рідке середовище циркулює навколо фізично
нерухомих клітин. Не дивлячись на переваги імобілізації клітин на плоскій
основі, їх промислове культивування має істотний недолік: горизонтальна
конструкція апарату створює незручності при роботі і вимагає великої площі. Ці
недоліки усуваються системою колоночної культури. При її ви-користанні зростає
число клітин, на які подається середовище, що збільшує “зону подачі”, де
відбувається накопичення значної кількості вторинних метаболітів (мал. 5.3).
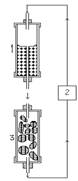
Малюнок 5.3.
Система культури в колонці
За результатами досліджень рекомендовані згальні підходи до
культивування клітин на основі отриманих результатів:
- клітини повинні вирощуватися фізично стаціонарно, в
тісному контакті одна з одною, щоб стимулювався розвиток фізичних і хімічних
градієнтів, забезпечуючи часткове диферен-ціювання культури. Деякі види рослин
необхідно культивувати при освітленні і індукувати утворення хлоропластів, щоб
забезпечити рівень метаболізму, близький до клітин інтактної рослини;
- склад поживного середовища і рівень кисню необхідно
регулювати для уповільнення росту культури. Рекомендується використовувати
регулятори росту для імітації процесів диференціації, що відбуваються in vivo.
- клітини необхідно забезпечувати попередниками, але в
низьких концентраціях. Попе-редники повинні бути максимально близькі в ланцюжку
перетворень до початкового продук-ту;
- бажано використовувати клітини, які секретують необхідні метаболіти в
поживне се-редовище або клітини, у яких таку секрецію можна індукувати.
5.8. Протопласти рослинних клітин як об'єкт біологічного конструювання.
Протопласти є
унікальною моделлю для вивчення фундаментальних фізіологічних проблем у рослин.
Вони незамінні при вивченні складу, структури і функціонування плаз-молеми в
нормі і при дії на неї гормонами, інгібіторами, фітототоксинами, а також при
взаємодії самих протопластів в популяції. Крім того, протопласти можуть
використовуватися для визначення складу і архітектоніки первинної клітинної
стінки і вивчення механізму її репарації після руйнування.
Основні напрями фізіологічних досліджень із використанням
культури ізольованих протопластів представлені
на малюнку 5.4.
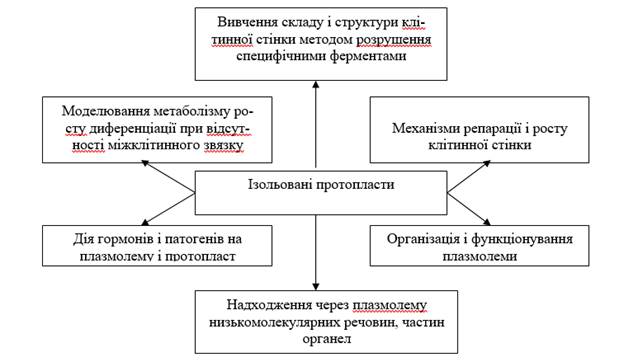
Малюнок 5.4.
Ізольовані протопласти - об'єкт і модель у фізіологічних дослідженнях
(по Р.Г. Бутенко, 1981)
Таким чином, ізольовані протопласти мають ряд напрямків застосування, як
теоретич-ного, так і прикладного характеру:
- вивчення хімії і структури клітинної стінки (і при
руйнуванні, і при синтезі «de no-vo»);
- вивчення властивостей плазмалеми, трансмембранних переміщень;
- «м'яке» виділення органели;
- спостереження за закономірностями диференціювання клітин
при злитті протопластів, відстежування взаємодії ядра і цитоплазми в отриманій
гібридній клітині, вивчення соматич-них гібридів;
- введення чужої органели;
- введення чужорідних генів в рослинну клітину (трансгенез).
Способи отримання і культивування
протопластів. Протопласт
- клітина, позбавлена целюлозної оболонки, оточена мембраною цитоплазми, що
зберігає властивості, властиві ро-слинній клітині. Вперше протопласти у 1892
році виділив Дж. Клеркер, який використо-вував механічний спосіб, вирізаючи у плазмідних клітин клітинну стінку. В
даний час метод зазнав модифікації та має ряд обмежень:
- невисока продуктивність;
- можна використовувати тканини тільки з екстенсивним
плазмолізом;
- трудомісткість і тривалість;
Інший метод виділення протопластів - ензиматичний,
з використанням ферментів. У 1952 році Салтон за допомогою ферменту лізоциму
вперше зруйнував клітинну стінку бактерій. У 1960 році Коккінг обробив кінчики
коріння томату гідролітичним ферментом з культуральної рідини цвілевих грибів (Myrothecium verrucaria) і вперше отримав ізольовані
протопласти вищих рослин ензиматичним способом.
Виділення протопластів проводять в три етапи: обробка
ферментами; виділення протоп-ластів із клітинних стінок; відділення інтактних
протопластів від клітинних залишків.
Протопласти виділяють і із суспензійних та клітинних
культур. Краще всього - в пізній стадії логарифмічного росту, коли клітинні
стінки легше піддаються руйнуванню, протопла-сти найбільш життєздатні.
Існують два способи культивування протопластів: метод рідких крапель (суспензію протопластів у вигляді крапель поміщають на пластикові
чашки Петрі) і метод платування (суспензію протопластів наливають в пластикові чашки Петрі).
На проліферацію клітин, що виникли із протопластів впливє: видова специфічність і фі-зіологічний
стан початкової тканини рослини; спосіб і умови виділення протопластів; щіль-ність висіву протопластів; склад
поживного середовища.
Злиття протопластів –
парасексуальна гібридизація. Ізольовані
протопласти, що ще не утворили клітинної стінки, можуть зливатися між собою. Їх
злиття - своєрідний метод гібри-дизації, так звана парасексуальна, або соматична гібридизація.
На відміну від звичайної, де зливаються статеві клітини (гамети), як
батьківські при парасексуальній гібридизації вико-ристовуються диплоїдні
клітини рослин. Техніка парасексуальної гібридизації дозволяє:
- схрещувати філогенетично віддалених видів рослин
(організмів);
- отримувати асиметричних гібридів, що несуть генний набір
один з батьків разом з де-кількома хромосомами, органелою або цитоплазмою
іншого;
- злитися трьом і більше клітинам;
- отримувати гібриди, що представляють суму генотипів
батьків;
- переводити мутації в гетерозиготний стан, що дозволяє
отримувати життєздатні фор-ми при злитті протопластів, оскільки мутагенез досить часто дає дефектну
по морфогенезу рослину;
- отримання рослин, гетерозиготних по позаядерних генах.
Злиття буває спонтанним (частіше у протопластів із молодих тканин або суспензійних культур) і
індукованим. Протопласти можуть зливатися як попарно, так і в більшій
кількості.
Доля геномів (ядерного і цитоплазми) після злиття протопластів може бути різною:
- ядерні генетичні детермінанти успадковуються як дво, так і однородинно. У
остан-ньому випадку ядра не зливаються і згодом сегрегують в процесі клітинних
ділень;
- позаядерні генетичні детерминанти успадковуються двородинно.
При цьому в міжви-дових комбінаціях відслідковується тенденція до соматичного
відщеплення і елімінацій од-ного із батьківських геномів цитоплазми.
- виникнення гібридних клітин і рослин в результаті злиття
більш ніж двох батьківських клітин.
Таким чином, злиття протопластів призводить або до утворення гібриду, або до
утво-рення цибриду. Соматичний гібрид - продукт злиття і
цитоплазми, і ядра обох протопластів. Цибрид
(гібрид цитоплазми) – рослина
- регенерант, що містить цитоплазму обох
батьків і одне з них ядро. Гібриди можуть бути отримані шляхом злиття трьох і
більш батьківських клітин, з яких можуть бути вирощені рослини - регенеранти.
Види соматичних гібридів.
Перша спроба по створенню міжродових гібридів належить Р. Мельхерсу,
який в 1978 році виростив гібрид: картопля + томат, так званий томатофель. Гіб-рид стерильний,
морфологічно аномальний: товсте коріння, відсутність типових столонів, махрові
квітки.
Ю.Ю. Глебом із співробітниками проводилися численні
експерименти по створенню міжтрибних гібридів
(тріба - таксономічна одиниця між видом і родом).
Перші роботи по отриманню міжродових гібридів проведені
К. Као і В. Веттером в 1976-77 роках (соя + тютюн).
Практично у всіх випадках спостерігалася видоспецифічна
елімінація хромосом одного з батьків. У культурах міжродових гібридів виявлено
багатоядерні клітини, клітини із мініяд-рами, в метафазах ділень зустрічалися
гігантські хромосоми. Відмічена асинхронність в роз-біжності батьківських хромосом в анафазі.
Для віддалених гібридів характерна:
- відносна стабільність гібридного стану, при якому не
спостерігається повної елімінації генетичного матеріалу одного з батьків;
- генетичні перебудови (реконструкція і часткова елімінація
хромосом);
- генетична різноякість
клонів гібридних клітин;
- обмежена морфогенетична здатність.
Вивчення міжвидових гібридів клітин "тварина +
рослина" показала, що на етапі злиття видоспецифічність не проявляється,
тому можна злити навіть тваринну і рослинну клітини.
5.9.
Конструювання клітин
Біологічне конструювання на рівні клітини може виявитися
корисним і перспективним для створення клітин, клітинних систем і цілих рослин
необхідних людині. Під біологічним конструюванням розуміють не тільки введення
окремої органели, але і чужорідний генетич-ний матеріал у вигляді фрагментів
ДНК та окремих хромосом. Крім того, в ізольовані прото-пласти
можна вводити клітини мікроорганізмів, створюючи таким чином штучні асоціації (мал. 5.5).
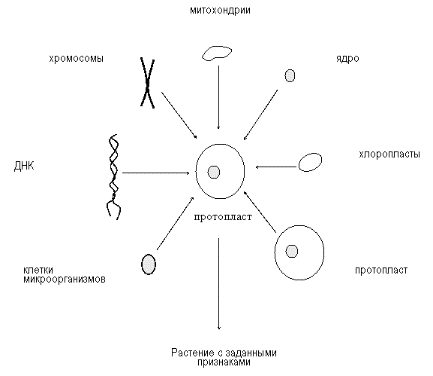
Малюнок 5.5.
Конструювання клітин (по Р.Г. Бутенко, 1987)
Клітинна селекція та її методи. Один з напрямів клітинних технологій - використання клітин в селекції,
яка полегшує і прискорює традиційний селекційний процес в створенні но-вих форм
і сортів рослин. Існуючі методи культивування ізольованих клітин і тканин in vitro умовно поділяють на:
- допоміжні
технології, які не підміняють звичайну селекцію, а її доповнюють (заплід-нення in vitro, подолання прогамної несумісності,
культивування сім'ябруньок і незрілих гіб-ридних зародків, подолання постгамної
несумісності, отримання гаплоїдів шляхом культиву-вання пилку і мікроспор,
кріозбереження ізольованих клітин, тканин і органів, клональне мікророзмноження
віддалених гібридів);
- самостійному, незалежному від традиційних методів
селекції, отриманню нових форм і сортів рослин: клітинна селекція з використанням
калусної тканини, соматична гібридиза-ція (злиття ізольованих протопластів і
отримання нестатевих гібридів), застосування методів генної інженерії.
У віддаленій гібридизації використовують методи культури
ізольованих тканин, як зап-ліднення in
vitro,
ембріокультура (вирощування ізольованих зародків на штучних поживних
середовищах), клональне мікророзмноження цінних гібридів, а також отримання
гаплоїдів in
vitro
і
кріозбереження.
Генетичні основи застосування культури клітин рослин в селекційних цілях in vitro від-різняються
по морфології, біохімічних властивостях, фізіологічному стану і генетично. Різ-номанітність
(варіабельність) серед клітинних ліній або рослин - регенерантів називають со-маклональною варіабельністю.
Поліморфізм культивованих клітин можна пояснити видовими і
віковими особливостя-ми, рівнем плодоїдності, впливом складу поживного
середовища і умов культивування, від-сутністю кореляційних зв'язків. Будь-який
фрагмент рослини є мозаїкою різних тканин, і залежно від того, яка тканина
дасть початок калусу, що виникли навіть з однакових експлан-тів калуси будуть
гетерогенними і такими, що відрізняються один від одного.
Фізіологічна гетерогенність полягає в
тому, що клітини в популяції знаходяться в різ-ному фізіологічному стані, тобто
діляться, ростуть, старі-ють, гинуть. Змусити популяцію клітин вищих рослин
проходити фази клітинного циклу одночасно, тобто синхронізувати їх, майже
неможливо.
Фізіологічна варіабельність клітин в
суспензійній культурі менша в порівнянні із куль-турою калусної тканини на
агарі, що пов'язано з однорідними умовами живлення, аерації і видалення
токсичних метаболітів з клітинного оточення в рідкому середовищі.
Гетерогенність культивованих клітин обумовлена генетичною, епігенетичною
і модифі-каційною мінливістю. Генетичні, або мутаційні, зміни призводять до
зміни генотипу, яка мо-же бути успадкованою. Мутації (зміни кількості або
структури ДНК) відбуваються на ген-ному, хромосомному рівнях.
Всі види генетичних змін мають місце у клітин in vitro. Навіть клітини однієї і тієї
ж тканини, що вирощуються в одній ємкості, значно розрізняються між собою по
кількості хромосом (диплоїдні, поліплоїдні, анеуплоїдні). Причини генетичної
мінливості багатогран-ні: порушення корелятивних зв'язків при виділенні
первинного експланта з рослини; дія ком-понентів середовища; вплив продуктів
метаболізму, що накопичуються в середовищі; гетеро-генність початкового
матеріалу і селекція клітин певного типу.
Хромосомна мінливість є результатом порушень мітозу,
спричинених ендомітозом і ен-доредуплікацією, що призводить до росту числа
хромосом, збільшення розмірів ядра і клі-тин.
Клітини різного рівня плодоїдності відрізняються швидкістю
ділення і росту, стійкістю до несприятливих умов, конкуруючи між собою. Такий
процес зростаючого домінування в популяції клітин певного типу називається клітинною селекцією (автоселекцією),
оскільки вона протікає спонтанно, без спеціальної дії якими-небудь стресовими
факторами. В процесі автоселекції формується найбільш пристосований до даних
умов каріотип.
Спонтанне або індуковане яким-небудь чинником утворення
різних форм рослин мож-на використовувати для поліпшення вже існуючих сортів
сільськогосподарських культур.
Спонтанний і індукований мутагенез в культурі клітин,
тканин і протопластів дозволяє отримувати рослини, що
представляють практичний інтерес для селекціонерів (створення форм рослин,
стійких до несприятливого впливу зовнішнього середовища: низькі температу-ри,
засолення ґрунтів, забруднення природного середовища токсичними речовинами,
пош-кодження шкідниками і ураження збудниками хвороб).
Для проведення клітинної селекції використовують прийоми:
- пряма (позитивна) селекція, при якій виживає лише заданий
тип мутанту клітоін;
- непряма (негативна) селекція, заснована на
цілеспрямованій загибелі клітин дикого типу і виживання метаболічно неактивних
клітин, що діляться, але вимагають додаткової ідентифікації у них мутаційних
змін;
- тотальна селекція, при якій індивідуально тестуються всі
клітинні клони;
- візуальна селекція і неселективний відбір, коли
досліджувана лінія може бути іденти-фікована серед всієї популяції клітин
візуально або при використанні біохімічних методів (тонкошарова або рідинна
хроматографія, радіоімунний аналіз, мікроспектрофотометрія).
З перерахованих вище прийомів клітинної селекції пряма
селекція є найбільш пошире-ним методом і використовується головним чином для
виділення рослин - регенерантів, стій-ких до гербіцидів, антибіотиків,
токсинів, важких металів, солей та інших антиметаболітів.
Для проведення робіт по клітинній селекції рослин в умовах in vitro, як
об'єкт дослід-ження, використовуються калусні, суспензійні культури або
ізольовані протопласти. Вибір об'єкту залежить від наявності розроблених
технологій стосовно різних видів рослин, а також від кінцевої мети
дослідження.
Калусна тканина є легко доступним матеріалом, який
найчастіше використовують для клітинної селекції. Проте для багатьох видів
рослин не розроблені ефективні технології і способи культивування одиноких клітин.
Тому, не дивлячись на недоліки використання ка-лусних культур, цей спосіб селекції залишається для
деяких видів рослин поки що єдино можливим.
Як початковий матеріал для селекції використовуються
культури соматичних або анд-рогенних ембріоїдів (сегменти листя або різні
меристематичні і стеблові частини рослин, а також культура ізольованих
зародків).
Таким чином, проведення селекції на клітинному рівні
дозволяє створювати нові форми рослин в 2-4 рази швидше в порівнянні з
традиційними методами.
Переваги методу клітинної селекції in vitro в порівнянні з експериментальним
мутаге-незом на рівні цілих рослин метод мутагенезу на рівні клітин:
- економиться площа, оскільки в одній чашці Петрі діаметром
- ознаки мутантів на рівні окремих клітин проявляються
досить швидко;
- можливе отримання нових типів мутацій, у тому числі і
біохімічного характеру;
- економиться час і трудовитрати на закріплення нової
бажаної ознаки.
Загальна
схема отримання форм мутантів шляхом селекції на клітинному рівні склада-ється
з етапів (мал. 5.6).
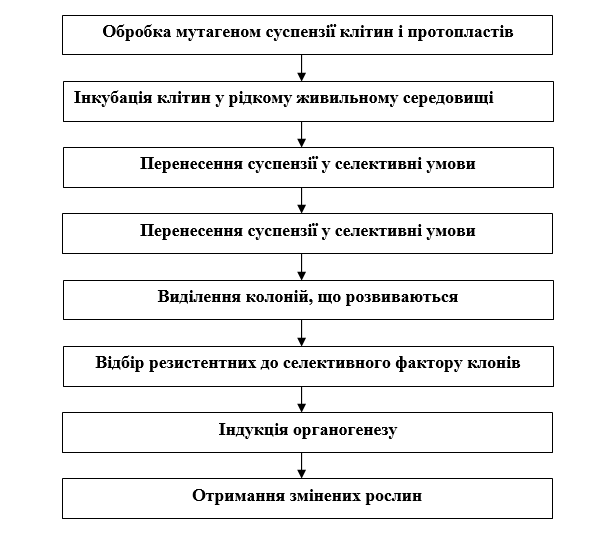
Малюнок 5.6. Схема отримання форм мутантів шляхом
клітинної селекції
(по В.І. Артамонову, 1989)
Змінені при мутагенній обробці клітини можуть бути виділені
в умовах культивування in
vitro
шляхом
прямого і непрямого відборів, а також при тестуванні окремих клітинних
ко-лоній. Прямий відбір полягає в додаванні до живильних середовищ окремих
компонентів, до яких звичайні, незмінені клітини не стійкі. Непрямий відбір
(негативна селекція) полягає в створенні умов культивування, при яких ріст
незмінених клітин або затримується, або ці клі-тини гинуть (наприклад,
культивування при низьких або високих температурах на середови-щах з нестачею
окремих компонентів).
Існує ряд факторів, що обмежують селекцію in vitro. Багато господарсько важливих
оз-нак (врожайність, кількість зерна, стійкість до пестицидів) важко або
практично неможливо отримати при культивуванні in vitro оскільки вони не проявляються
на клітинному рівні. Не-достатньо і біохімічних і молекулярних маркерів, які
корелювали б з цими ознаками на рівні цілих рослин. Не всі селективні ознаки, що проявляються на рівні
клітин, зберігаються на рівні рослин - регенерантів. Тому декілька причин: деяка частина змін не
торкається генетич-ного апарату клітини, тому не зберігається у нащадків;
генетичні зміни можуть елімінува-тися в процесі диференціації і мейозу; функція
мутантного гена може бути обмежена станом клітин, що диференціюються і
культивованих; мутація одного гена може супроводжуватися активацією різних
генів, що кодують ізоферменти; частина генотипів нездатна регенерувати
нормальні фертильні рослини.