Тема
2. ОБ’ЄКТИ ТА МЕТОДИ БІОТЕХНОЛОГІЇ.
План:
2.1. Об'єкти біотехнології.
2.2. Методи біотехнології.
2.2. ДНК, її структура та функції.
2.3. Поняття
генетичного коду: основні властивості.
2.4. Плазміди, їх
значення для молеккулярно генетичної інженерії.
2.5. Функціонування генів: гіпотеза оперону.
2.6. Генетична рекомбінація in vitro: методи введення гену у плазміду.
2.1.
Об'єкти біотехнології
Бiотехнологiя вирiшує не тiльки конкретнi завдання науки i виробництва.
Вона роз-ширює i прискорює за допомогою досягнень науково-технiчного прогресу
масштаби впливу людини на живу природу, сприяє пристосуванню живих систем до
умов iснування людини, виступаючи в ролi потужного фактора антропогенної
адаптивної еволюцiї. В минулому вплив людини на живi органiзми був обмежний
штучним вiдбором. В даний час штучний вiдбiр входить у бiотехнологiю, що
формується, як одна із її iсторичних пере-думов. Цей глобальний
(загальнобiологiчний) i конкретний (науково-виробничий) аспекти взаємовiдносин
бiотехнологiї з живою природою тiсно контактують i стимулюють один одного. Вони
є єдиною системою, яка на верхньому рiвнi змикається з еволюцiєю, а на
нижньому поєднує живу природу з
соцiальною i виробничою сферами життя людини.
За своїми можливостями бiотехнологiя екологiчно досить чистий i
практично неви-черпний високоекономiчний виробник рiзноманiтної продукцiї i
тому все бiльше витiсняє недосконалi, обмеженi ресурсами та екологiчно шкiдливi
сучаснi хiмiчнi технологiї. Од-нак для прогресуючої бiотехнологiї необхiднi
успiхи фундаментальних наук i бiльш дос-коналi об’єкти та методи оперування живими системами.
Об'єкти біотехнології - це
представники основних груп живих організмів - мікроор-ганізми (бактерії,
віруси, дріжджі, одноклітинні організми), рослини, тварини, ізольовані з них
клітини та субклітинні компоненти. Біотехнологія базується на фізико -
хімічних, біохімічних, фізіологічних процесах, які протікають у живих системах,
в результаті яких проходить виділення енергії, синтез і деградація продуктів,
формування організованих структур. Для
вирішення наукових завдань
в біотехнології є достатня
матеріальна база. Обмежує її використання недостатність знань
про живі об'єкти і процеси які в них відбу-ваються, відсутність досконалої
техніки і методів управління ними та жорсткі вимоги до рівня рентабельності
біотехнологій. Саме тому види і групи живих організмів та їх кліти-ни вводять в
сферу біотехнологій поступово, в міру подолання обмежуючих факторів.
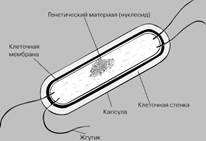
Бактерії це
-
одноклітинні мікроорганізми, які характеризуються відсутністю оболон-ки
клітинного ядра. Генетичний матеріал бактерії (дезоксирибонуклеїнова кислота,
або ДНК) в клітині займає визначену
зону, яку прийнято називати нуклеотидом. Організми з такою будовою клітин
називаються прокаріотами («доядерними») на відміну від інших - еукаріот
«істинно ядерних», ДНК яких знаходиться в оточенні оболонки ядра (мал. 2.1, 2).
Біотехнологічні функції бактерій
різнопланові. Їх використовують при виробництві: харчових продуктів (оцту Gluconobacter
suboxidans),
молочно-кислих напоїв (Lactoba-cillus, Leuconostoc);
мікробних інсектицидів (Bacillus thuringiensis); білку (Methylomonas);
вітамінів (Clostridium - рибофлавін); розчинників і
органічних кислот; біогазу і водню.
Корисні бактерії відносяться до
еубактерій. Оцтовокислі представлені родами Glu-conobacter і Acetobacter - це
грамнегативні бактерії, які перетворюють етанол в оцтову ки-слоту, а оцтову
кислоту в вуглекислий газ і воду. Родина Bacillus відноситься до грампо-зитивних бактерій,
здатних утворювати ендоспори і
мають перитрихіальне жгутикування. B. subtilis - аэроб, а B. thuringiensis може жити і в анаеробних умовах.
Анаеробноутво-рюючі спори
бактерії представлені родиною Clostridium. C. acetobutylicum
зброджують
цукри в ацетон, етанол, ізопропанол і n-бутанол (ацетобутанолове бродіння), інші види можуть зброджувати крохмаль, пектини та різні азотовмісні сполуки.
Малюнок
2.1. Будова бактерії
Малюнок 2.2.
Види бактерій
До молочнокислих бактерій відносяться
представники родів Lactobacillus,
Leuconostoc і Streptococcus, які не утворюють спор,
грампозитивні і нечутливі до кисню. Гетерофер-ментативні молочнокислі бактерії
родини Leuconostoc перетворюють вуглеводи в
молочну кислоту, етанол і вуглекислий газ. Гомоферментативні молочнокислі
бактерії родини Stre-ptococcus
продукують тільки молочну кислоту, а бродіння, проводять представники роди-ни Lactobacillus, продукуючи з молочною
кислотою різноманітні продукти.
До бактерій родини Corynebacterium, нерухомі грампозитивні
клітини яких не утво-рюють ендоспор, відносяться патогенні (C.diphtheriae, C.
tuberculosis) і
непатогенні грун-тові види, які мають промислове значення. Бактерії широко
використовуються і в генно-інженерних маніпуляціях при створенні геномних
клонотек, введенні генів в рослинні клітини (агробактерії).
Промислові штами мікроорганізмів повинні
відповідати певним вимогам: здатністю до розмноження на дешевих поживних
середовищах; високою швидкістю росту і кінцево-го продукту; мінімальним
утворенням побічних продуктів; стабільністю продуцента у ви-робничих процесах;
безпечністю продуцента і кінцевого продукту для людей і навко-лишнього
середовища. В зв’язку з цим всі мікроорганізми, які використовуються в про-мисловості проходять тривале випробування на безпечність для
людей, тварин та навко-лишнього середовища. Важливою властивістю продуцента повинна бути його стійкість до
інфекції, що дуже важливо для підтримання стерильності і фагостійкості
технологічних процесів.
Перспективними продуцентами білку є
ціанобактерії, які володіють здатністю до азот-фіксації: анабена (Anabaena) -
нитчата синьо-зелена водоросль, носток, спируліна, три-ходесміум придатні до
використання людиною і можуть безпосередньо використовува-тися в їжу.
Переваги спируліни в
порівнянні із іншими водорослями в
простоті культивування, збору біомаси, висушування та її використання.
Встановлено, що в клітинах спируліни, окрім цінного білку, вуглеводів, ліпідів,
вітамінів, в значній кількості мітиться полі-b-ок-сибутират - сировина для фармацевтичної
промисловості при виробництві препарату «Сплат» на основі ціанобактерії Spirulina platensis, який
містить комплекс вітамінів та мікроелементів і застосовується як
загальноукріплюючий та імуностимулюючий засіб.
Гриби. До
нижчих їх видів відносяться еукаріоти - Mycota:
мікроміцети, тобто мікро-скопічні гриби (дріжджі, пеніціли, аспергіл) і мікроміцети,
які формують в процесі свого росту і розвитку візуально видимі плодові тіла -
трутовики, агарікові гриби…). Їх вико-ристовують для виробництва: антибіотиків
(пеніциліну, цефалоспорину); гіберелінів і ци-токінінів (фузаріум і ботритіс);
каротиноїдів (астаксантин, який надає мякоті лососевим рибам червоно-оранжевого
відтінку); білку (Candida, Saccharomyces lipolitica);
сирів типу рокфор і камамбер (пеніціли); соєвого соусу (Aspergillus oryzae).
Міцелій їстивних
грибів яких можна вирощувати на рідких
середовищах (на молочній сиворотці) у ферментаторах
повністю механізований та
автоматизований процес. По вміс-ту
білку
До грибів відносять дріжджі та плісені.
Із 500 видів дріжджів першими люди
навчи-лись використовувати Saccharomyces cerevisiae, які
найбільш інтенсивно використову-ються і в даний час. До дріжджів, які зброджують лактозу, відносяться Kluyveromyces fragilis, використовуючи для
отримання спирту із сиворотки. Saccharomycopsis lipolytica
переробляє вуглеводи і використовується для отримання білкової маси. Всі вони належать до класу аскоміцетів. Дейтероміцети (несправжні гриби)
відносять до класу корисних
ви-дів оскільки вони розмножуються не статевим шляхом, а брунькуванням. Candida utilis
росте в сульфітних стічних водах (відходи
паперової промисловості). Trichosporon cuta-neum, окислює
численні органічні сполуки, в тому
числі і деякі токсичні (фенол), відіг-раючи важливу
роль в системах аеробної
очистки стоків. Промислові дріжджі не размно-жуються статевим шляхом, не утворюють спор, що пояснює їх здатність адаптуватися до
зміни середовища культивування.
Плісені викликають багаточисленні
перетворення в твердих середовищах, які
переду-ють бродінню. Їх присутність сприяє гідролізу рисового крохмалю при
виробництві саке і гідролізу соєвих бобів, рису, і солоду при приготування їжі,
яку вживають в азіатських країнах. Харчові продукти на основі зброджених
пліснявими грибами Rhizopus
oligospo-rus
соєвих бобів або пшениці містять в 5-7 разів більше рибофлавіну, нікотинової
кисло-ти) і відрізняються підвищеним вмістом білку. Вони продукують ферменти,
які викорис-товуються в промисловості (амілази, пектинази), органічні кислоти і
антибіотики, прийма-ють участь при виробництві сирів (камамбера і рокфора).
Водорості, як
правило є водними організмами. Всі вони пігментовані за рахунок при-сутності
хлорофілу, каротиноїдів, ксантофілів, фітобілінів. Розмножуються вегетативним
та статевим шляхом. Водорості - важливе джерело поліцукрів, та біологічно
активних ре-човин. Використовуються в основному для виробництва білку. Перспективними є культу-ри одноклітинних водоростей,
зокрема високопродуктивних штамів
родини
Chlorella і Scenedesmus. Їх біомаса після відповідної обробки використовується в якості
кормової добавки тваринам та в харчових цілях. У відкритих басейнах із
спеціальним поживним се-редовищем за теплий період року (6-8 місяців) отримують
50-60 т/га біомаси хлорели (лю-церна 15-20 т), в якій міститься біля 50 % білку
(в люцерні біля 18 %), 40 % вуглеводів, 7-10 % жирів, вітаміну А (в 20 раз
більше), B2, К,
РР, мікроелементи. Гідролізати білку зеле-ної водорості Scenedesmus
використовують
в медицині і косметичній промисловості (мал.
2.3).


Малюнок 2.3. Види водоростей
Цінним продуктом, який отримують із
червоних водоростей є агар - поліцукор, кіль-кість якого сягає 30-40 % ваги
водоростей (водорості лауренція, грацілярія, гелідіум). Во-дорості - єдине
джерело отримання агару, агароїдів, карагініна, альгінатів.
Бурі водорості джерело солей альгінової
кислоти, альгінатів, які широко використову-ються в народному господарстві
(високоякісні мастила для машин, медичні і парфюмерні мазі та креми, синтетичні
волокна, стійкі до погодніх умов, лакофарбові покриття, вироб-ництво шовку,
клеючих речовин, будівельних матеріалів, фруктові соки, консерви, моро-жено,
стабілізатори розчинів).
Калусні культури макрофітних водоростей
використовуються для виробництва
білку, який безпосередньо
використовують в їжу, як харчові добавки та в корм тваринам.
Найпростіші це - одноклітинні
мікроскопічні тварини, які поширені в природі, а окре-мі з них присутні в організмі
людини. По будові вони нагадують клітини тварин і містять всі нобхідні
структурні елементи (органоїди і включення). По типу живлення - гетеро-трофи,
які володіють спеціальними структурами для захвату їжі або її поглинають шляхом
фагоцитозу. Найпростіші відносяться до нетрадиційних об’єктів біотехнології.
Особливу екологічну нішу вони займають в рубці жуйних тварин, де завдяки
присутності ферменту целюлази сприяють розкладанню клітковини.
Структурні поліцукри, які присутні в
складі клітинних мембран найпростіших це - ге-терополіцукри, які містять
глюкозу, манозу, ксилозу, арабінозу, рибозу, галактозу, рам-нозу, фруктозу,
глюкозамін.
Характерною їх особливістю - високий
вміст ненасичених жирних
кислот 60-80 % від суми
жирних кислот. У жгутиконосців фосфоліпіди і поліненасичені жирні
кислоти
мають склад і будову аналогічну людині і тваринам. В світі мікробів
поліненасичені жирні
кис-лоти не
синтезуються, а багатоклітинні
тварини або рослини представляють обмежену си-ровинну
базу, ніж
найпростіші, культури яких можна отримувати методами біотех-нології незалежно від часу року або кліматичних умов.
Біомаса найпростіших містить до 50 %
білку, який володіє високою біологічною
здат-ністю: містить всі незамінимі амінокислоти, причому вміст вільних
амінокислот на поря-док вищий, ніж в біомасі мікроводоростей, бактерій і в
м’ясі, що свідчить про широкі мо-жливості їх використання в якості кормового
білку.
Використання рослин в біотехнологічних процесах (на відміну від водоростей де
від-сутня диференціація тіла на органи і тканини), вищі рослини (тіло має
органи і тканини) широко використовують біотехнологічних процесах виробництва
необхідних людині ре-човин, нових видів (сортів) рослин, які володіють високою
продуктивністю та мають кра-щу якість вирощеної продукції. В даний час сотні тисяч видів
рослин використовують в біотехнологічних процесах в різних
галузях народного господарства.
Для них
характерні здатність до
фотосинтезу, наявність
целюлози, біосинтез білку
та крахмалю.
Лишайники це -
природні симбіонти грибів (мікобіонтів) і водоростей (фікобіонтів), або грибів
і ціанобактерій (бактеріобіонтів). Це самостійна група організмів,
мікобіонтами в яких виступають переважно аскоміцети (рідко - базидіоміцети),
фікобіонтами і бакте-ріобіонтами - зелені і жовто-зелені водорості,
ціанобактерії. Размножуються безстатевим шляхом (кусочками, конідіями) і
статевим шляхом за рахунок мікобіонта (мал.
2.1.4).
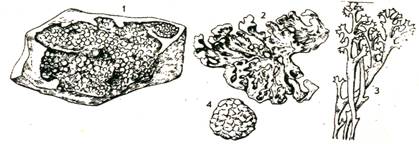
Малюнок 2.1. 4. Лишайники. де:
1 - корковий або накипний, 2 - листоватий,
3 - кустистий, 4 - кочуючий.
Лишайники є потенційними біообєктами для використання при виробництві
різнома-нітних речовин.
Віруси характеризуються найменьшими розмірами
(вимірюються в нанометрах), воло-діючи облігатним паразитизмом. Структурно
віруси представляють організовані частинки, які містять один тип нуклеїнової
кислоти (РНК або ДНК), не
володіючи власним обміном речовин, проте здатні до реплікації в клітинах
організму - господаря, або інтеграції з його геномом (рис. 2.1.5...2.1.7).

Під організованістю вірусної частинки (вірона), розуміють специфічну
будову струк-турних блоків, характерну для того або іншого вірусу, який існує
поза організмом. Кож-ний віріон в очищеному вигляді це - кристал побудований
із нуклеїнової кислоти і білку, які не зв’язані один з одним ковалентними
зв’язками.
Нуклеїнові кислоти - речовини спадковості вірусів. По типу нуклеїнової
кислоти їх поділяють на РНК - вмісні (всі віруси рослин) і ДНК - вмісні віруси
(більшість бактеріофа-гів, окремі віруси людини і тварин).
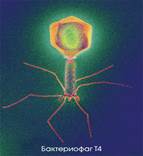
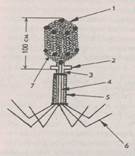
Малюнок 2.1. Бактеріофаг Т2(А). де:
1 - капсомерш, покриваючий головку, 2 - воротнічок, 3 - шийка, 4 - порожній
стержень, 5 - чехол, 6 - нитки, 7 - ікосаздрична головка; мендсикути Б
(а-д): галобактерії (а), метанобактерії (б), вегетативні форми (в) і сплячі форми (г); термоацідофіли
(д); тенерикути (є): мікоплазми (ж), спіроплазми (з).
Віроїди це - однолянцюгові, ковалентно
замкнуті, кільцеві молекули РНК позбавлені капсидів (структурованого навколо
вірусної нуклеїнової кислоти білку у вигляді оболон-ки). Кожний тип віроїда
містить унікальний, лише йому присутній, особливий вид низько-молекулярної РНК.
В клітинах рослин - господарів вони присутні в ядрі, асоціюючись із ядерцем у
вигляді білково - нуклеїнового комплексу та розмножуються автономно за
до-помогою попередніх або активізованих ферментів господаря.
Окрім перерахованих об’єктів, які використовуються при біотехнологічних
процесах виробництва продуктів біотехнологій є і інші, які поки що не знайшли
достатнього поши-рення. Для реалізації біотехнологічних процесів важливими параметрами біооб’єктів є чистота,
швидкість розмноження клітин і репродукції вірусних частинок, активність і стабільність
біомолекул та біосистем.
2.2.
Методи біотехнології.
На початковому етапi свого
розвитку бiотехнологiя в основному користувалась живи-ми системами в тому
виглядi, в якому вони iснували в природi. Наступним було викорис-тання
традицiйних методiв селекцiї (штучного вiдбору) мiкроорганiзмiв, рослин i
тварин, отримання бiльш продуктивних штамiв, лiнiй.
За останнi роки цiлеспрямоване покращення властивостей живих систем, як
об’єктiв бiотехнологiї, рiзко прискорилось i розширилось пiсля того, як були
розробленi методи ге-нетичної iнженерiї. Спочатку це були методи рекомбінування
та конструювання очищу-них із клітин генів, дещо пізніше удосконалені методи
переносу генів в модифіковані ор-ганізми, а в кінці 70-х років минулого
століття відпрацьовані підходи до переносу генів у культивовані клітини тварин.
В 1980-1982 роках з'явились методи переносу генів в цілі (багатоклітинні)
тваринні організми і майже одночасно - методи переносу генів в рослинні
клітини, в цілі рослини. Модифіковані
організми, а також клітини, які
ростуть поза орга-нізмом,
після переносу в них нових генів називаються генетично трансформованими клі-тинами. Трансформованими можна назвати і багатоклітинні
організми - тварини, росли-ни, але частіше їх називають трансгенні тварини або
рослини.
Генетичний матеріал переносять в клітини і організми за
допомогою різних методів:
- в модифіковані організми гени вводять
в склад кільцевих молекул - плазмід, додаю-чи їх в середовище культивування;
- в
клітини тварин гени вводять додаючи їх в середовище культивування або
вприс-куванням (мікроін'єкцією) за допомогою мікропіпетки.
Особливі
прийоми використання переносу генів в цілі тваринні форми. Один із них полягає
в тому, що очищені гени вводять в тільки що запліднені яйцеклітини (зиготи) за допомогою
шприца і мікропіпетки, кінчик якої має діаметр близько 1 мкм безпосередньо в
ядро. Ген можна перенести в ембріон і з допомогою вірусів. Існує 2 підходи
переносу ге-нів в рослини. Перший
характеризується тим, що гени вводять в ізольовані клітини, що позбавлені
полісахаридних стінок (протопласти). Потім із цих клітин отримують цілі рос-лини. При другому підході використовують ДНК
(Ті-плазміди) модифікованих організмів Agrobacterium tumefaciens, які здатні заражати рослинні клітини і переносити в них
части-ну Ті-плазміди разом із чужерідною ДНК. Ген, що переносять, вводять в
цю частину Ті-плазміди.
-
пробій, вистрелюють в певні клітини вольфрамовими кулями, які несуть чужі гени,
безпосередньо вводячи в ядро.
2.2. ДНК, її
структура та функції.
У кінці 1868 року, всього через 3 роки
після публікації даних Менделя, швейцарський лікар і хімік Ф. Мішер виділив із
ядер клітин лейкоцитів, які накопичувалися в гної хво-рих, речовину, яку він
назвав нуклеїном - ДНК.
ДНК - це надзвичайно довгі полімерні
ланцюги (E. coli - 4 млн. пар основ -
Функція ДНК полягає в тому, що:
- містить запас генетичної інформації,
необхідної для кодування структури всіх білків і всіх РНК кожного виду
організму;
- регулює в часі і просторі біосинтез
компонентів клітин і тканин;
- визначає діяльність організму на
протязі його життєвого циклу; -
- забезпечує індивідуальність даного
організму.
Будь-яка ДНК складається з одних і тих
же 4 типів нуклеотидів (які містять одну із азотистих основ): А, Т, Г і Ц.
Пирімідинові основи. Пуринові основи. Нуклеотиди складаються
із 3-х компонентів: азотистої основи; пентози (рибоза або дезоксирибоза);
залишку фосфорної кислоти таким чином, що основа зв'язана N-глікозидним зв'язком з 4-м атомом С пентози, а залишок фо-сфорної
кислоти - складноефірним зв'язком з 5-м атомом С пентози.
Дезоксирибонуклео-тидні компоненти ДНК у вільній формі при рН=7,0.
Послідовно розташовані нуклеотиди в
молекулах ДНК і РНК ковалентно зв'язані один з одним при допомозі фосфатних
“містків”. 5-а гідроксильна група пентози одного нукле-отиду приєднана до 3-ї
гідроксильної групи пентози сусіднього нуклеотиду при допомозі фосфодиефірного
зв'язку.
Усі ланцюги ДНК і РНК полярні, оскільки
всі міжнуклеотидні фосфородиефірні зв'яз-ки орієнтовані вздовж ланцюга
однаково. Завдяки цій полярності кожний полінуклеотид-ний ланцюг має 5-й кінець
і 3-й кінець.
Міжнуклеотидні зв'язки в ДНК і РНК можна
хімічно розщепити гідролізувавши за
до-помогою ферментів, які називаються нуклеазами. Деякі нуклеази здатні
розщепляти зв'яз-ки між двома сусідніми нуклеотидами, розташованими всередині
ланцюга ДНК або РНК. Такі нуклеази називаються ендонуклеазами. Нуклеази іншого
класу можуть каталі-зувати гідроліз тільки зв'язку кінцевого нуклеотиду або
5-го або 3-го кінця молекули; ці
фермен-ти відносяться до екзонуклеаз.
Американський біохімік Чаргафор
кількісно проаналізував нуклеотидний склад ДНК і показав, що загальна кількість
пуринів 6 молекул ДНК дорівнює кількості піримідинів, а вміст А = вмісту Т, а Г
= Ц. Крім цього ним та радянськими вченими А. Спіріним і А. Білозерським було
встановлено, що відношення А + Т до G + C може суттєво відрізнятись у різних видів: у
деяких вірусів і бактерій воно дорівнює 0,36-0,39; у пекарських дріжджів - 1,8,
у людини - приблизно 1,1.
Справжню
будову ДНК і пояснити “правила Чаргафора” зуміли Дж. Уотсон і Ф. Крік. Трохи
більше року потрібно було їм, щоб зрозуміти, що ДНК складається із 2-х полінук-леотидних ланцюгів, причому пурини і піримідини,
нерегулярно розташовуються в одно-му ланцюгу, з'єднані водневими зв'язками і пурини і
піримідини в другому. Цей зв'язок між основами в протилежних ланцюгах підтримує
спіральну конфігурацію молекул ДНК. Ланцюги ДНК закручуються навколо загальної
осі у подвійну спіраль, витки якої, якщо дивитись вздовж спіралі, ідуть зліва
направо, тобто за годинниковою стрілкою. Спарені основи розташовані площинами
один на одного і перпендикулярно осі. Вся структура ДНК нагадує гвинтові сходи,
перила яких утворюють цукровофосфорні залишки окремих нуклеотидів, з'єднані між
собою, а сходи - спарені
основи. Важливим є принцип комп-лементарності
- специфічне з'єднання основ: А завжди з'єднується з Т, G
з C. Модель
“подвійної спіралі” швидко отримала визнання ще й тому, що пояснювала як може
відбу-ватися процес самокопіювання або реплікації.
Слід відмітити ряд важливих постулатів
сучасної генетики і молекулярної біології, які були встановлені Дж. Бергом та його співробітниками при вивченні біохімічних мутацій у
пліснявого грибка -
нейроспори. Перший із них ® один ген ® один фермент. Другий – ге-нетичний
код триплетний. Пізніше, коли стало відомо, що багато із білків - ферментів
побудовані із декількох ланцюгів АК - поліпептидів, формула була дещо змінена: один ген - один поліпептидний ланцюг. В ДНК трійка нуклеотидів називається
триплетом. Будучи переписаною на т-РНК, вона отримує нове ім'я - кодон.
Найважливіша
властивість генетичного коду -
його універсальність. Один і той же центр використовується для запису
амінокислотного складу ферментів, відповідальних за різні ознаки дуже далеких
організмів - від еукаріот до
позбавлених ядра бактерій і синьо - зелених водоростей, об'єднаних під загальним терміном - прокаріоти, і зовсім безклітин-них вірусів і бактеріофагів. Саме завдяки йому
інформація, зашифрована в гені одного ор-ганізму, може бути правильно прочитана в іншому, навіть віддаленому виді, отримавшо-му цей ген по волі людини. На цьому
грунтується вся практика генетичної
інженерії.
Генна інженерія та сфери її застосування. Генетична рекомбінація полягає в обміні генами між двома
хромосомами. За визначення, яке дав Понтекорво в 1958 році, реком-бінація
-
це процес, який здатний призвести до виникнення клітин або організмів з двома або
більше спадковими детермінантами, за якими їх батьки розрізнялись між собою і
з’єд-нані між собою новим способом. Така рекомбінація
обовязково відбувається у савців при утворенні статевих клітин. В процесі
мейозу гомологічні хромосоми обмінюються генами (так званий кросенговер); саме ці
обміни дозволяють пояснити появу спадкових ознак у ряді поколінь. У вірусів і
бактерій генетична рекомбінація відбувається рідше, ніж у тва-рин. Обмін генетичним матеріалом, за яким проходить рекомбінація, відбувається між ор-ганізмами одного і того ж, або близького видів. Всі живі організми володіють рестрик-ційними ендонуклеазами, які впізнають чужерідну ДНК, що
проникла в організм, і розще-плюють
її, таким чином зводячи до нуля генетичну рекомбінацію між еволюційно відда-леними геномами.
Генетична рекомбінація in
vitro. Обмін
генами, рівно як і введення в клітину гена, що належить іншому виду, можна
здійснити шляхом генетичної рекомбінації in vitro. Цей під-хід
був розроблений на бактеріях, а саме на кишковій палочці, в клітини якої
вводили гени тварин і людини і домагалися їх реплікації.
Метод рекомбінації in vitro
полягає у виділенні ДНК із різних видів, отриманні гібрид-них молекул ДНК і
введенні рекомбінантних молекул в живі клітини з тим, щоб домог-тись нової
ознаки, наприклад синтезу специфічного білку
(мал.1).
Виділення генів, які являють собою
сегменти ДНК, здійснюються на основі біохі-мічних методів. Складність їх
виділення залежить від величини генома. Тоді як певний ген вірусу виділити
відносно просто, для гена людини це дуже складне завдання. Тому дослідники
застосовують непрямий метод, що полягає у виділенні інформаційної РНК (мРНК): в
клітинах тварин транскрипція мРНК на ДНК відбувається в клітинному ядрі; молекули мРНК переносять інформацію з ядра в
цитоплазму, де вона використовується при трансляції білків, амінокислотні
послідовності яких закодовані в послідовностях нук-леотидів мДНК (в кінцевому
результаті в ДНК); в клітинах бактерій (прокаріот), які не ма-ють ядра,
транскрипція і трансляція відбуваються одночасно і поєднанні міє собою. мРНК
зв’язана з рибосомами, в яких відбувається з’єднання амінокислот з утворенням
білків. Рибосоми відіграють ключову роль в трансляції і в клітинах тварин .
Поряд
з інформацією про стуктуру білків (записаної за допомогою генетичного коду)
молекула ДНК містить ряд регуляторних сигналів, записаних у вигляді специфічних
нук-леотидних послідовностей. Ці сигнали є початком транскрипції чи трансляції, інші (а са-ме, між генами) вказують точки призупинення зчитування генетичної інформації. Гене-тичний код універсальний для всіх живих організмів,
іншими словами, дана послідовність ДНК обовязково кодує один і той самий білок
в клітинах різних організмів, тоді як регу-ляторні сигнали в клітинах тварин і в бактеріальних
клітинах не однакові. В клітинах тва-рин інформація про структуру білку може кодуватися не одною безперервною ділян-кою ДНК, а декількома сегментами, розділеними ділянками
ДНК, що носять назву інт-ронів.
Інформаційна РНК, яка транскребується з ДНК, підлягає розщепленню, в результаті
якого всі інтрони видаляються з її послідовності, а решта залишаються фрагментами, або екзо-нами, з`єднуються разом з утворенням молекули мРНК, яка
має послідовність, що кодуює послідовність амінокислот білку, містить регуляторні сигнали, необхідні для по-чатку і закінчення процесу трансляції.
Для експресії в бактеріальній клітині
гена з клітини тварини необхідно, щоб в клітину була введена молекула ДНК з
послідовністю нуклеотидів, що кодують білок, з якого інт-рони вже видалені;
іншими словами, потрібна молекула ДНК, синтизована на відповідній мРНК
зворотньою транскриптазою. Більше того, регуляторні сигнали повинні бути схожі
на відповідні бактеріальної клітини. Накінець, для отримання потрібного білку в
достатній кількості необхідні додаткові зміни бактеріальної клітини.
Методи введення ДНК в бактеріальні клітини. Для введення ДНК (генів) в клітини бактерій
використовують два методи. В основі першого
лежить застосування плазми в якості вектора. На початку 1950-х років, незадовго
після відкриття Ладербергом процесу коньюгації Escherichia coli, встановлено, що типи “спарювання” клітин
бактерій зумовлені генетично і що генетична інформація переноситься з клітин
чоловічого в клітини жіночо-го типу, або реципієнтні клітини. Здатність бути донорними клітинами (або фактор пло-дючості F) передавалась при коньюгації значно частіше,
ніж інша генетична ознака. F-фа-ктор
передається незалежно від іншого відомого гену донорної клітини. Ладерберг
вста-новив, що F-фактор нагадує позахромосомні генетичні елементи,
що наявні в цитоплазмі вищих організмів. Це спостереження дозволило йому в 1952
році присвоїти подібним позахромосомним генетичним системам
спільну назву - плазміди.
У 1953 році Хейс, який в той час
працював в лікарні Хаммерсміта в Лондоні, встано-вив, що в певних умовах F-фактор може виявитись зчепленим з генетичними
маркерами і індукувати їх послідовне переміщення в ході коньюгації. F-фактор приєднується до бакте-ріальної
хромосоми в специфічній ділянці (сайті); саме в цій точці хромосома розвиваєть-ся
при коньюгації і розпочинається її перенесення в реципієнтну клітину. F- фактор здат-ний відділятися від хромосоми,
захоплюючи невеликі фрагменти хромосоми; тому його можна розглядати як
позахромосомний елемент, який інтегрує в хромосому.
Жакоб і Вольман, співробітники Інституту
Пастера в Парижі, відмітили схожість в по-ведінці F-фактора, помірного бактеріофага, і плазміди - ColEl (яка кодує коліцин - білок, який вбиває
клітини Е. coli). Для позначення генетичного елементу, який може репліциру-ватися у вільний стан, або з’єднуватися з бактеріальною хромосомою, вони запропонува-ли новий термін - “ епісома”.
У 1959 році в Японії при дослідженні
хворих бактеріальною дизентерією, які не під-давалися лікуванню ефективними
антибіотиками, було зроблено наукове відкриття. В клі-тинах патогенних бактерій
(Shigella
dysenteriae) були
знайдені гени, які надавали їм стій-кість одночасно до декількох антибіотиків;
така стійкість передавалась іншим кишковим бактеріям багато в чому подібно
тому, як передається F-фактор.
Ці фактори стійкості (які називаються R-факторами)
володіли подібністю з F-фактором,
оскільки вони були здатні індукувати передачу самих себе від клітини до клітини
при конюгації. Пізніше вдалося показати, що деякі з них містять послідовності
нуклеотидів, близькі до F-фактора.
На початку 1960-х років Новік виявив
подібні фактори в стафілококів. Вони містили ген, який кодуює фермент
пеніцилін-В-лактомазу, або пеніциліназу, остання розщеплює пеніцилін і таким
чином забезпечує стійкість до даного антибіотика. R-фактори стафіло-коків, не можуть забеспечувати передачу самих себе за
допомогою коньюгації і перено-сяться
тільки пасивно в процесі трансдукції, тобто при їх перенесенні в ДНК бактеріо-фага. Це відкриття вказувало на наявність декількох
R-факторів в клітинах кишкових бак-терій.
До середини 1960 років стало очевидним,
що більшість R-факторів
кишкових бактерій і стафілококів (так і плазміда ColEl) відрізняються від F-фактора і фага тим, що залиша-ються поза
хромосомними елементами; зворотнього їх вбудовування в хромосому клітини не
відбувається. В 1963 році Новик запропонував користуватись терміном “плазміда”, як
більш загальний, а не “епісома”. В
даний час термін “плазміда” є загальнопринятим.
Плазміди
знайдені майже у всіх видів бактерій. Штамм, що містить плазміду, може давати
початок варіантам, у яких плазміда втрачена; в подібних випадках плазміда губи-ться остаточно, клітина не може її регенерувати і може
тільки отримати із іншої бакте-ріальної
клітини. Плазміди представляють собою кільцеві
молекули ДНК, які по розміру відповідають 1-3% генома бактеріальної клітини,
проте навіть така достатньо мала части-на спадкового апарату кодує важливі генетичні ознаки, які
зазвичай сама бактеріальна клітина не кодує. Наприклад, вони містять
інформацію, необхідну для коньюгації бактері-альних клітин, ними обумовлений ряд захворювань рослин і
тварин. Вони дозволяють клітинам використовувати складні сполучення в
якості джерел живлення і забезпечують стійкість до різноманітних токсичних
агентів, особливо до антибіотиків. Плазміди стафі-лококів несуть гени стійкості до пеніциліну, сполученням
ртуті і ряду важких металів, які викликають летальний єфект (солями сурми,
вісмута, кадмія і свинцю, іонам арсената і арсеніта). Гени стійкості до важких
металів знайдені і в складі
R-плазмід E. coli. Наявніс-тю
плазмід обумовлені деякі захворювання з вираженою діареєю, стафілококовий імпеді-го, створожування молока і перетворення його
молочнокислими бактеріями в сир, а також різноманітні біохімічні реакції,
характерні для бактерій роду Pseudomonas. Плазміди можуть керувати
синтезом інсектицида в клітинах Bacillus thuringiensis. Використання
плазмід в якості векторів для введеня чужерідних генів в бактеріальні клітини
починаючи з 1975 року стало
поштовхом інтенсивних досліджень
їх структури і характеру реплікації.
Кількість плазмід в клітині може
коливатись від однієї до більше сотні; в цілому чим крупніша плазміда, тим
менша кількість її копій в клітині. Зазвичай реплікація плазміди регулюється
незалежно від реплікації хромосоми. Оскільки плазміди можуть розрізнятися по
кількості копій в одній і тій самій клітині, то кількість копій має визначатися
регуля-торною системою, присутньою в самій плазміді. Така система описана в
1972 році датча-нином Нордстрьомом із Університета Оденсе для плазміди R1 E. coli. Подібні регуляторні системи знайдені у
плазмід стафілококів. Кількість копій плазміди R1 залежить від білку або білків, які
пригнічують її реплікацію. Сегмент ДНК довжиною не більше двох тисяч пар керує
реплікацією плазміди, яка більше ніж у 50 раз більша за нього.
Тривалий час вважалося, що генетична
конституція всіх клітин даного виду однакова і не змінюється протягом тривалого
часу, проте, як виявилось, значна частина генетичних ознак, причому не тільки в
бактерій, але й у вищих організмів - нестабільна (ці ознаки існують в одних
клітинах або штамах і відсутні в інших. Клітини можуть губити і прид-бати їх
знову) і мобільна (може переноситись між клітинами або переміщатися в одній і
тій же клітині з одного локуса в інший). Така
нестабільність пояснюється тим, що ці озна-ки визначаються плазмідами і іншими атипічними генетичними
системами.
При коньюгації бактеріальних клітин може
проходити обмін плазмідами між бактері-ями, що належать до різних видів і
навіть родів, які не здатні обмінюватись генами, що присутні в хромосомах.
Накінець, такий обмін може призводити до переносу генів, які знаходяться в
плазміді, із одного виду в інший при спільному рості і конкуренції, в
резу-льтаті чого реціпієнтні клітини набувають здатності виживати за рахунок
клітин - донорів. Ці властивості показують, що плазміди здатні до виживання незалежно
від клітин, що їх утримують, вони не тільки не знижують загальної
пристосованості клітини, але, навпаки, постачають її додатковими адаптивними
функціями. Насправді, плазміди мають власти-вість включати в себе нові гени, а
гени, що містяться в них “перетасовують”
так, що це, з однієї сторони, не впливає на ефективність реплікації самих
плазмід, а з іншої - наділяє клітину резервуаром генетичної інформації, яку
вона при потребі використовує.
Другий метод, яким дослідники користуються для введення гена в
бактеріальні клітини, базується
на застосуванні бактеріографа в якості вектора. Ген вбудовують в геном вірусу (який містить 10-50 генів), і він реплікується разом із
генами вірусу при розмноженні останнього в бактеріальній клітині.
Експресія в клітинах бактерій рекомбінантних ДНК. Бактеріальна
хромосома довжи-ною біля 1мм - це молекула ДНК, що складається приблизно із 3
млн. нуклеотидів. У клітині вона
компактно укладена в декілька тисяч раз і займає простір менше 1 мкм в розрізі.
В клітинах людини ДНК організована в 46 хромосомах, кожна із них містить молекулу ДНК довжиною біля
У дослідах по експресії генів в клітинах
бактерій спочатку зі спеціалізованих клітин тварин, що утворюють специфічний
білок (наприклад, інсулін), виділили мРНК, який кодує цей білок, потім за
допомогою зворотньої транскриптази синтезували нитку ДНК, комплементарну мРНК.
Іншу нитку, комплементарну ДНК-копії, отримували з викорис-танням фермента - ДНК-полімерази. На слідуючому етапі двуниткову ДНК-копію
перено-сили в плазміду з використанням ферменту кінцевої
трансферази, яка нарощує на кінцях ДНК коротку послідовність нуклеотидів (для
утворення інсуліну Гілберт
нарощував на ДНК послідовність із чотирьох нуклеотидів зі залишками цитозина).
Плазміду розщеплю-вали на
спецефічній ділянці рестрикціонною ендонуклеазою PstlI. Конкретною плазмідою,
яку використовував Гілберт для одержання проінсуліну щура, була pBR322. Ця плазміда характерна для клітин E. сoli і
містить два гена, які визначають стійкість до пеніциліну і тетрацикліну;
рестрикціонна ендонуклеаза розщеплює плазміду в середній частині гена, який
кодуює пеніциліназу. Після розщеплення плазміди на її кінці за допомогою
кінцевої трансферази надбудовували послідовність із чотирьох нуклеотидів із
залишками гуаніну. Після цього кінці двох одержаних молекул ДНК могли
з’єднуватись через взаємодію ком-плементарних послідовностей нуклеотидів (гуаніна
з цитозином); за допомогою бактеріа-льного фермента ДНК-лігази - здійснили
зшивку ДНК-вставки і плазмідної ДНК. Утворе-на нова кільцева плазміда представляла собою молекулу
рекомбінантної ДНК (мал. 1, 2).
Зазвичай такі молекули рекомбінантних
ДНК не проникають крізь клітинну стінку ба-ктерій, проте розбавлений розчин
хлористого кальцію робить клітини проникними, і деякі з них утворюють нову
плазміду. Ці клітини можна
відібрати, використовуючи генетич-ний маркер стійкості до антибіотику. Плазміда pBR322,
використана в дослідах для здійс-нення синтезу інсуліну в бактеріальних клітинах була розрізана в середній частині гена пеніциллінази, а вбудований в плазміду фрагмент чужерідної ДНК порушував
синтез фра-гменту, проте ген,
який забезпечує стійкість до тетрацикліну, залишається активним. То-му, якщо суспензію бактерій розмазували по поверхні поживного агару,
який містить тетрациклін, кожна окрема клітина, що містить рекомбінантну ДНК і
стійка до тетрацик-ліну,
була здатна до ділення і утворення колонії, з якої можна одержати клон клітин,
які містять чужорідну ДНК в складі рекомбінантної плазміди. Бактеріальні
клітини цього клону синтезували б потрібний білок, структура якого закодована у
введеному в них ДНК.
Труднощі в отриманні молекул
рекомбінантних ДНК і досягненні їх повної експресії в бактеріальній клітині
впершу чергу пов’язані із виділенням їх з клітин тварини потрібного гена -
необхідної послідовності ДНК. Для дуже мілкого гена, який кодує невеликий
білок, базуючись на генетичному коді і знаючи послідовність амінокислот в цьому
білку, вдає-ться передбачити послідовність нуклеотидів, яку можна хімічно
синтезувати. Це завдання вирішено в Національному медичному центрі “Хоуп”
(Дуарте, Каліфорнія) Ітакурою зі співробітниками. Вчені синтезували молекулу
ДНК довжиною 42 нуклеотида, яка може кодувати соматостатин - гормон
гіпоталамуса, що викликає пригнічення виділення інсулі-ну і гормону росту у
людини. Молекули соматостатину складаються із 14 амінокислот. Синтез
послідовності ДНК проводили, з’єднуючи тринуклеотиди; із 52 пар нуклеотидів
синтетичного гена 42 пари складали структурний ген соматостатину, а інші
нуклеотиди служили для приєднання синтетичного гена до плазміди pBR322, а також до сегменту лактозного оперона (lak) із генома E.
coli.
Другий напрямок подолання проблеми
полягає у виділенні не ДНК (гена), а відпо-відної мРНК, якої зазвичай багато в
клітинах, які спеціалізуються на синтезі певного біл-ку; наприклад, мРНК
інсуліну присутня в клітинах островка Лангерганса в підшлунковій залозі, а мРНК
гемоглобіна - в червоних кровяних клітинах. Ця мРНК не містить інтронів
відповідних генів - інтрони вирізаються із неї за участі спеціальних ферментів,
тому вона може транслюватися в бактеріальній клітині (гени останньої не мають інтронів).
Зворотня транскриптаза може копіювати однониткову РНК із утворенням
комплементарного лан-цюга ДНК (цей фермент є у певних РНК які містять віруси і
які у циклі розмноження здій-снюють зворотню транскрипцію своєї РНК в ДНК). На однонитковій ДНК-копії за допо-могою ДНК-полімерази синтезують комплементарний ланцюг
ДНК.
Одержана в резуль-таті дволанцюгова ДНК-копія відповідає гену, який потрібно
було виділити, але при цьо-му із неї видалені всі інтрони. Синтезована таким
чином ДНК-копія містила регуляторні сигнали, необхідні для її транскрипції і
трансляції в бактеріальній клітині. Сигнали
в бак-теріальних клітинах і в клітинах тварин були різними.
Один із них є сигналом початку си-нтезу
мРНК з утворенням білку. Присутні сигнали про закінчення транскрипції
і трансля-ції.
Чужорідну ДНК можна вбудовувати
безпосередньо за бактеріальним геном чи в сере-дині його після розщеплення ДНК
рестрикціонною ендонуклеазою. Проводять це для того щоб уникати труднощів,
пов’язаних з ініціацією транскрипції і трансляції чужерідної ДНК. В результаті
утворюється гібридний білок, в якому послідовність амінокислот чуже-рідного
білку відповідає бактеріальному. Синтетичний
ген соматостатина був вбудований в плазміду pBR322 E. coli близько до
кінця гена, кодуючого в-галактозидазу, між двома генами якої поміщений кодон метіоніну. Після введення рекомбінантної
плазміди в бак-теріальну клітину
кишкова паличка стала синтезувати гібридний білок. Частину його, яка
представлена соматостатином, відщеплювали від в-галактозідази обробкою
бромціаном, який розриває білковий ланцюг по залишку метіоніну. Такий складний
спосіб одержання гормону необхідний, оскільки соматостатин, синтезований у
вигляді вільних молекул, швидко деградує під дією бактеріальних протеаз.
Чужерідну ДНК можна вбудовувати в ген
бактеріального білку, що секретується в нормі і крізь клітинну стінку назовні.
В такому випадку необхідність екстракції білку із клітини відпадає, оскільки
білок виділяється у зовнішнє середовище.
В листопаді 1977 року Бойєр, один з
засновників фірми “Генентек”, повідомив про перший синтез складної молекули
соматостатину в бактеріальних клітинах зі зміненним геномом (вихід
соматостатину становив 10 000 молекул на клітину). Із
Біосинтез інсуліну людини в клітинах кишкової палочки. У 1979 році із 60 млн.
хворих діабетом у всьому світі тільки 4 млн. отримали препарат інсулін. В США число діабетиків, які потребували ін’єкції
інсуліну, становило в 1979 році 1,8 млн. чоловік (із них 100 000 дітей). Ця
кількість щорічно зростає на 6 %. У Франції зареєстровано 1 млн. хворих діабе-том, 150 000
із них мали потребу в інсуліні, 300 000 - в лікувальній дієті, а 550 000 інсуліну не потребували.
Форма діабету, для лікування якої потрібний інсулін, викликана вибірковою
смертю клітин, що синтезують цей гормон (першим звернув увагу на роль островків
Лангерганса в підшлунковій залозі в етіології діабету в 1921 році Едвард Шарпі-Шафер, який і назвав інсуліном речовину, що
секретується цими острівками). Форми діа-бету, для лікування яких інсулін не потрібний, зустрічаються
частіше, з ними вдається справлятися відповідною дієтою.
У 1921 році Бантінг і Бест в Торонто
виділили із підшлункової залози собаки гормон, існування якого було передбачено
Шарпі-Шафером, і продемонстрували його антидіабе-тичний ефект. В 1922 році
інсулін, виділений із тварини, був вперше введений дев’яти-річному хлопчику, хворому на діабет. Результат перевершив
всі сподівання. Вже через рік американська компанія “Елі Ліллі” випустила
перший препарат тваринного інсуліну. Підшлункова залоза великої рогатої худоби і свиней зазвичай не використовується в м’ясній і
концервній промисловості і доставлялись бойнями. Досвідчений персонал по
розробленій методиці здійснює добування залоз із туш, їх швидко заморожують і
направ-ляють у вагонах-рефражераторах на фармацептичні
підприємства, де і проводиться екст-ракція гормона. Підшлункова залоза корови важить 200-
В 1935 році датський вчений Хагедорн
добився оптимізації дії інсуліну в організмі, розробив препарат інсуліну
пролонгованої дії. Його засвоєння було сповільнено добавкою протаміна, а потім і цинку. В 1946 році датські дослідники отримали нейтральний криста-лічний інсулін (NPH), який широко застосовувався в
інсулінотерапії. Пізніше співробіт-ники компанії “Ново індастрі” (Копенгаген) встановили, що
введення протаміну
не є необхідним для отримання препарату пролонгованої дії. Із того часу в
розпоряджені лікарів є довгодіючі (поглинаються протягом 48 годин) і швидкодіючі препарати інсуліну.
Діабетик,
який потребує лікування інсуліном, має отримувати в середньому 40 оди-ниць гормону в добу. Вдосконалення методів виробництва
дозволило виробляти концент-ровані препарати для ін’єкцій (100 одиниць замість 40),
тобто проводити ін’єкцію заданої кількості гормона в меншому об’ємі.
Перші кристали інсуліну отримані у 1952
році, а розвиток методів очистки гормону (імуноелектрофореза і рідинної
хроматографії високого вирішення) від інших гормональ-них речовин (наприклад,
глюкагона-антогоніста інсуліну і соматостатину, який подавляє виділення
інсуліну і глюкагону) і різних продуктів деградації інсуліну дозволило
одер-жати гомогений інсулін, який називають однокомпонентний.
Інсулін
побудований із двох поліпептидних ланцюгів А і В довжиною 20 і 30 аміно-кислот, послідовність яких встановлена Сенгером у 1955 році.
Синтез обох ланцюгів і з’єднання їх дисульфідними зв’язками для одержання
інсуліну проведені в 1963 і 1965 роках трьома колективами дослідників в США,
Китаї і ФРН, проте
здійснити в промис-ловому
маштабі цей дорогий і складний синтез, який включає 170 хімічних реакцій, вия-вилось важко. У 1980 році
датська компанія “Ново індастрі” розробила метод перетворен-ня інсуліну свині в інсулін людини заміщеням залишків
аланіну, який є 30-ю амінокисло-тою
в ланцюгу В, на залишок треоніну. Цього вдалось досягнути шляхом ферментативно-го заміщення з наступною хроматографічною очисткою
продукту; в результаті був отри-маний однокомпонентний інсулін людини 99 %-ої чистоти.
Дослідження двох одноком-понентних
інсулінів (людського і свинячого) показали, що вони не розрізнялись по актив-ності і по часу дії. В 1982 році інсулін випускали головним чином дві компанії: “Елі Ліл-лі” (85 % збуту в США і патент з 1923 року) і “Ново індастрі” (47,5 % збуту гормону в Європі).
В організмі тварин два поліпептидних
ланцюжки інсуліну спочатку є частинами однієї білкової молекули довжиною 109
амінокислот - проінсуліна. При синтезі препроінсуліну у в-клітинах
підшлункової залози перші 23 амінокислоти виконують роль сигналу для
про-ходження молекули крізь мембрану клітини. Ці амінокислоти відщеплюються, в
резуль-таті утворюється проінсулін довжиною 86 амінокослот. Молекула
проінсуліну згортається таким чином, що початковий і кінцевий її сегменти
зближуються, а центральна частина молекули віддаляється під дією ферментів. Так синтезується інсулін. Роль центральної ча-стини зводиться до правильного взаємного розміщення двох
ланцюгів інсуліну.
Гілберт із співавторами виділили мРНК
інсуліну з пухлини в-клітин підшлункової залози щура (в той час особливі
обмеження досліджень не дозволили їм працювати із ге-ном людини). ДНК-копію
мРНК вбудували в плазміду pBR322 E. coli, в середню частину гена пеніцилінази -
цей фермент в нормі секретується із клітин. Як показало визначення послідовності ДНК, рекомбінантна
плазміда одержала інформацію про структуру проінсуліну, але не сам проінсулін. При трансляції мРНК в
клітинах кишкової палочки синте-зувався гібридний білок, який містить послідовності
пеніциллінази і проінсуліну.
Пізніше Набер і Чік із лабораторії Елліота П. Джослинга в Бостоні показали, що
одержані таким методом
молекули впливають на цукровий обмін, як гормон, виділений із підшлункової
залози щура.
В 1979 році Креа, Крашевскі, Хіроуз і
Ітакура з Національного медичного центру “Хоуп” (Дуарте, Каліфорнія) за три
місяці синтезували гени, що кодують А -і В-ланцюги інсуліну: кожен ген був
зібраний відповідно із 18 і 11
олігонуклеотидів. Синтез цих генів в
свою чергу проведено
Гьодделем у співпраці
з компанією “Генентек”. Як і у випадку ге-на соматостатіна, кожний синтетичний ген вбудували в
плазміду в кінці гену в-галак-тозідази
E. coli K12. Синтезовані поліпептиди відщеплювали від ферменту,
проводили їх очистку, з’єднуючи
ланцюги in vitro для одержання повної молекули інсуліну. На початку в
бактеріях синтезувалося біля 100 000 молекул інсуліну на бактеріальну клітину.
В клітинах E. coli проведено біосинтез проінсуліну, а не
тільки її окремих ланцюгів А і В. Для
цього на мРНК проінсуліну за допомогою зворотньої транскриптази синтезували її
ДНК-копію. Біосинтез проінсуліну, молекула якого звертається і після утворення
дису-льфідних зв’язків утворює молекулу інсуліну, має перевагу, оскільки
різноманітні етапи екстракції і виділення гормону зведені до мінімуму.
За спостереженнями американської
компанії “Елі Ліллі”, включення, які містять про-інсулін А -і В-ланцюги
інсуліну, можуть займати до 20 % об’єму клітини E. coli.
Гілберт із співробітниками підвищили вихід гормону, який синтезується в
клітинах бактерій, вбудо-вою в ДНК коротких послідовностей нуклеотидів
(промоторів), які забезпечували більш високий рівень експресії ДНК в складі
рекомбінантної плазміди. Крім того,
в одну бакте-ріальну клітину можна
ввести декілька копій рекомбінантної плазміди. В Центрі прик-ладної мікробіології і досліджень в Портон - Дуане (Великобританія) одержаний високий вихід такого білку -
до
Вченим компанії “Генентек” потрібно було
10 місяців, щоб у вересні 1978 року одер-жати інсулін людини в спеціально
сконструйованому штаммі кишкової палички. Вироб-ництво інсуліну в бактеріальних
клітинах не залежить від перебоїв у доставках сировини з боєнь і дозволяє
одержати людський інсулін, який при довготривалому використанні не викликає
неприємних наслідків, як інсулін тварин (мається на увазі порушення роботи
ни-рок і погіршання зору. У кожного із
кожних 20 хворих діабетом, інсулін
тварин викликає алергію). “Ені Ліллі” спільно із “Генентек” вклала 40 млн. доларів у будівництво заводу для промислового виробництва інсуліну у американському місті Індіанаполіс
(шт. Індіа-на), маючи намір
приступити до випуску гормону у 1983 році.
Комнанія “Ново Індастрі” спільно із
“Біоген” налагоджує виробництво інсуліну люди-ни, використовуючи метод
рекомбінантних ДНК до мікроорганізмів, відмінним від киш-кової палички. Такого роду кооперація обумовлена прагненням розпочати
промисловий випуск інсуліну людини в ті ж строки, що і “Ені Ліллі”. Національна рада Канади по дос-лідженням і канадські лабораторії Коннаута теж виявляють
інтерес до синтезу інсуліну в генетично сконструйованих штаммах дріжджів.
Починаючи з липня 1980 року наявної
кількості синтезованого гормону виявилось до-статньо, щоб розпочати клінічні
випробовування і фармокологічні дослідження у США, Франції, Японії і
Великобританії. У серпні того ж року група англійських медиків опуб-лікувала
результати досліджень інсуліну, синтезованого в сконструйованому штаммі
киш-кової палички. Після експериментів на тваринах препарат випробуваний на
людях. Дос-лідження проводились у відділенні порушення обміну Лондонської
лікарні на 17 доб-ровольцях у віці 24-56 років. Для досліджень, препарат інсулін одержаний із лабора-торії “Елі Ліллі”, де його синтезували по методу
розробленому у 1978 році
компанією “Генен-тек”.
Варіації в степені глікемії, зареєстровані при підшкірному чи внутривенному вве-денні цієї речовини, порівнювали з такими при введені
гормону, одержаного з під-шлун-кової залози свині що традиційно використовуєтья для лікування діабету. Результати в обох
групах були еквівалентні, а незначні відмінності пояснювались різницею в концет-раціях препаратів при їх випробовуванні.
В березні 1982 року японська компанія
“Сіоногі” (Осака) провела клінічне досліджен-ня інсуліну людини, що
виробляється фірмами “Елі Ліллі ”, “Генентек”. Побічних ефектів препарату
виявлено не було.
Після того як було доказано
нешкідливість короткочасного примінення гормону, син-тезованого бактеріальними
клітинами, потрібно було перевірити імунологічні реакції па-цієнтів при
довготривалому курсі лікування, щоб проконтролювати ступінь чистоти пре-парату,
і тільки після того прийняти рішення про його використання для терапії в
широ-ких маштабах. Це відносилось і до синтетичного проінсуліну людини,
гомологічному нативному проінсуліну, проте його імуногенні властивості при
довготривалому примі-нені вимагали більш детальних досліджень.
У жовтні 1982 року управління по
контролю за якістю харчових продуктів, медика-ментів і косметичних засобів (FDA) дало згоду на випуск в США “хемуліна” -
препарата синтетичного інсуліну людини, що виробляється фірмою “Елі Ліллі” яка затратила 100 млн. доларів, щоб розпочати промислове виробництво і поставку продукту на ринок. Мі-сяцем раніше подібне рішення по відношенню до хемуліна
було прийняте у Великоб-ританії. Обидва рішення приняті через п’ять місяців після регістрації
препарату в FDA на основі довготривалих результатів клінічних досліджень по
відношенню до безпечності прийому, проведених на здорових добровольцях і на
1000 хворих діабетом в ряді
країн (400 із них в США).
Біосинтез соматотропіна і інших гормонів людини. Гормон
росту людини, чи сомато-тропін, який секретується передньою долею гіпофіза,
вперше виділений і очищений у 1963 році колективом на чолі з Русом із гіпофіза,
одержаного із трупного матеріалу. Його
нестача призводить до гіпофізарної карликовості, який зустрічається від 7 до 10
випадків на мільйон людей (у західних країнах 1 на 5000 дітей). Гормон володіє
видовою специ-фічністю і є єдиним засобом лікування дітей, що страждають від
такої недуги. Як показа-ли дослідження, при внутримязевому введені
соматотропіну в дозах вище 6 мл на
У
1981році із одного трупа вдалось одержати 4-6 мг соматотропіна в
перерахунку на кінцевий фармацептичний препарат. Проте доступні кількості
гормону росту були обмежені і не задовільняли зростаючого попиту. При участі Національного агенства гіпофізу США
щорічно одержували 650000 міжнародних одиниць соматотропіну, яких було достатньо для лікування 1500 дітей в рік. У
Великобританії переробка гіпофізу в 1978 році дозволила виробити достатньо соматотропіну для адекватного
лікування в Медичній
дослідницькій раді декількох сотень випадків гіпофізарної карликовості. Проте в
1982 році кількість зібраного матеріалу виявилось менше, і
англійські лікарні одержали всього 336 000 міжнародних одиниць яких
вистачило для лікування лише 800 дітей. У Франції низькі поставки гіпофізу
змусили
медичну адміністрацію резервувати вкрай дорогий спосіб лікування (30 000 - 60 000 франків на одну дитину в рік) лише для чітко
встановлених клінічних випадків серед хворих, які вже одержували гормон (у 1982 році
препарат одержували 800 дітей, а деякі продовжували одержувати його на протязі
5-и і більше років).
Шведська
компанія “Кабі вітрум АБ” випускала майже 60% світового запасу сомато-тропіну. До числа інших виробників гормону росту
відносяться фірми “Нордиск інсулін” (Данія), “Серано” (Італія і Швейцарія) і
Національне агенство гіпофізу в
США. Проте за-гальної кількості
препарату вистачало для
лікування лише однієї третьої випадків гіпофі-зарної карликовості в розвинутих країнах. Нестача
соматотропіну стає більш
гострою, як-що врахувати і інші
випадки застосування гормону, такі, як незаживаючі переломи (неп-равдиві суглоби), опіки, язви і порушення гомопоеза. (ефективність гормону при цих пато-логічних випадках, коли проявляється анаболічна дія,
доказана клінічними дослідження-ми).
Окрім нестачі препарату виникли і інші
проблеми, пов’язані з гетерогенністю гормо-на, що виділяється з трупного
матеріалу. Він представляє собою суміш із декількох форм, п’ять із яких мають
масу 22 000 дальтон, інші є димерами нативної форми, а ще інші - фрагментами,
що утворюються при протеолізі. Тому у
30% хворих, що одержали препа-рат,
проти гормону вироблялись антитіла, які зводили нанівець його біологічну актив-ність, хоча вдосконалення виділення і очистки гормону призводило до
зниження таких випадків до 5%. Існувала небезпека, що гіпофізний матеріал заражений вірусами, які
по-вільно розвиваються. Такі віруси володіють незвичайно
довгим інкубаційним періодом, тому діти, які одержали препарат, мали потребу
багаторічного медичного обстереження.
Гормони росту людини, синтезовані в спеціально сконструйованих клітинах бактерій, мають
очевидні переваги: доступні у
великих кількостях, препарати є біохімічно чистими і вільними від вірусних забруднень. Шведська фірма “Каби витрум”,
яка з 1967 року дос-ліджує можливість виробництва синтетичного соматотропіну, в серпні 1978 року підпи-сала
договір з американською компанією “Генентек” відносно одержання методами генної
інженерії штамма бактерій, який зможе синтезувати цей гормон. Через вісім
місяців після початку спільної діяльності вчені “Генентек” одержали штамм E. coli К12, який
володіє цією властивістю.
Біосинтез соматотропіну (що складається з 191 амінокислотного залишку (мал.
3) був проведений Гьодделем і його колегами у фірмі “Генентек”. Оскільки
при синтезі ДНК на мРНК гормону із наступним перетворенням її в двохниткову
форму виходить ген, який кодує попередника соматотропіну, який не розщеплюється в бактеріальних клітинах з
утворенням активного гормону, дослідники вибрали слідуючий підхід. На першому
етапі клонували двохниткову ДНК-копію мРНК з розщепленням рестрикціонними ендонукле-азами одержуючи послідовність, яка кодує всю амінокислотну послідовність
гормону, за виключенням перших 23-х амінокислот. Потім клонували синтетичний
полінуклеотид, який відповідає амінокислотам від 1-ї до 23-ї, зі стартовим ATG
кодоном на початку. Накінець, два фрагменти об’єднали разом і вмонтували до пари lak - промоторів в ділянці зв’язування рибосом. Кінцевий вихід гормона становив 2,4 мкг на 1 мл культури або 1% від розчинних білків
клітини такого генетично сконструйованого штамму E. coli (тобто
100 000 молекул гомона на клітину). Синтезований в бактеріях гормон володів
потрібною молекулярною масою і не був зв’язаний з яким-небуть бактеріальним
білком, від якого його необхідно було б відщеплювати. Проте синтетичний гормон
містив на N - кінці поліпептидного
ланцюга додатковий залишок метіоніна. Ця зайва амінокислота могла бути видалена при довготривалому
вирощуванні кишкової палички, але одержані при цьому кількості соматотропіна
були дуже низькі: всього декілька мілліграм на 1л куль-турального
середовища за 7-
В червні 1980 року вчені компанії
“Генентек” представили FDA
результати, які дока-зували, що соматотропін з додатковим залишком метіоніна,
синтезований в генетично сконструйованих клітинах бактерій, володіє біологічною
активністю нативного гормону. Вони провели порівняння стимуляції росту щурів з
видаленим гіпофізом гормону росту, синтезованим в клітинах бактерій, і
препаратом, одержаним із гіпофіза людини. Приріст маси і ріст великих бедрових
кісток були одинакові для обох препаратів гормону окремо, так і для їх суміші.
Згідно іншого тесту, бактеріальний соматотропін володів підвищеним ефектом, ніж
гормон росту із гіпофізу, що пояснювалось чистотою першого препарату. Введення
в кишечник щура з видаленим гіпофізом бактерій, які синтезують соматотропін, не
супроводжувалось збільшенням маси, хоча ці бактерії частково виживали в
кишковому тракті гризунів на протязі декількох днів.
В Сан-Франциско дітям, які страждають
гапофізарною карликовістю, на протязі трьох місяців вводили соматотропін, який
синтезований в клітинах бактерій і містить додат-ковий залишок метіоніну. При цьому зареєстровано збільшення росту на 8-
У 1981 році клінічні дослідження і тести
на токсичність, що проводились “Генентек” і “Кабі вітрум”, були завершені, і в
наступному році в Канаді, США, Європі і Японії розпо-чаті масові дослідження на
дітях, які страждають карликовістю і по віку близьких до статевої зрілості. Із
серпня 1982 року “Кабі вітрум” прийняла рішення розпочати виробни-цтво
синтетичного соматотропіну в промисловому маштабі на заводі в Стренгнесі в
фер-ментерах об’ємом
Гормон
росту людини в клітинах кишкової палички і в культурі живих клітин був
одержаний в 1982 році в інституті Пастера в Парижі де передбачалось
його промислове
виробництво.
Вважається, що біосинтез соматотропіну
призведе до зниження вартості лікування оскільки, згідно з оцінками
американських вчених, ціна 1 міжнародної одиниці гормону знизиться із 15 до 5 доларів, особливо якщо
розширяться можливості його застосування (висловлювались припущення, що
соматотропін вдасться використати для стимуляії росту домашніх тварин і
збільшити надої молока у корів). У Великобританії вартість ампули, що містить 5
одиниць гормону становить
Замінюючи амінокислотну послідовність,
тобто його первинну структуру засобами модифікації кодуючого гена, в
бактеріальних клітинах можна синтезувати аналоги гор-мону, дуже важливі для
вивчення активних ділянок молекули (наприклад, ділянок, які стимулюють ріст або
діють на неоглюко-генез) і етіології карликовості на молекулярному рівні.
Використовуючи методи рекомбінантних ДНК, можна синтезувати і інші фактори
деференцію-вання тканин, виділивши спочатку їх мРНК, а потім одержавши
відповідні гени. Це відноситься до
соматомедину А, який стимулює фіксацію сірки в хрящі і утво-рення якого індукується соматотропіном. Це відноситься
також і
до соматомедину В, який стимулює синтез ДНК в клітинах глії. В генетично
сконструйованих клітинах можна синтезувати і інші соматомедини, які індукують включення проліну в колаген чи уридини в ДНК.
У 1982 році Гійємен із співробітниками
(Інститут біологічних досліджень Солка в Ла-Джлле, Каліфорнія) виділили і
синтезували поліпептид, який володіє повною біологічною активністю
гіпоталамічного рилізінг-фактора соматотропіну (СТГ-РФ), виділення якого із
гіпоталамуса до цього часу не
проводилось. Ці дослідження мають важливе терапевтичне значення для людей, оскільки введення даного
поліпептиду може компенсувати
нестачу соматотропіну. У 1968 році, група Гийємена виділила і синтезувала перший гіпотало-мічний рилізінг-фактор - рилізінг-фактор тиреотропного гормону (ТТГ-РФ), який
регулює роботу щитовидної залози. При співробітництві декількох колективів
медиків вчені виді-лили із
пухлини підшлункової залози людини, що викликає акромегатію, рилізінг-фактор
соматотропіну (СТГ-РФ), а потім
синтезували цей поліпептид, який зв’язаний з утворен-ням пухлини і складається із 44 амінокислотних залишків.
Хоча ще не доведено, що сама-тотропін
СТГ-РФ із пухлини підшлункової залози є ідентичний
гіпоталамічному СТГ-РФ, який виділений із гіпоталамуса, проте дозволено проводити клінічні дослідження на лю-дях, використовуючи синтетичний поліпептид. Після
закінчення таких досліджень можна буде рекомендувати його для застосування не лише для лікування гіпофізарної карлико-вості,
але і при деяких формах діабету, а також для прискорення регенерації тканин у
лю-дей, які одержали сильні опіки. Наявність достатньої
кількості фактора, який володіє усі-ма властивостями гіпоталамічного рилізінг-фактору гормону
росту, поряд з біосинтезом соматотропіну в генетично сконструйованих
бактеріальних клітинах призведе
до коріного перелому в лікуванні захворювань, які обумовлені нестачою цього
гормону, а також знач-но
полегшить терапію в ряді
різноманітних паталогічних випадків. Цей фактор, можна
буде використовувати і для збільшення маси і росту домашніх тварин:
оскільки структура соматотропіну видоспецифічна, використання фактора, що діє на рівні
гіпоталамуса, доз-волить
уникнути затруднень, які
пов’язані з виділенням і синтезом соматотропіну різних видів тварин, оскільки
цей фактор, стимулює звільнення гормону росту у ряді тварин.
Компанія
“Генентек” планувала випуск соматостатину, який синтезується спеціально сконструйованими штаммами бактерій. Проте, як
стверджують деякі вчені, при виробни-цтві пептидів, що складаються менше ніж із 20 амінокислотних залишків, потрібно від-давати перевагу хімічному синтезу, а не біосинтезу в
генетично сконструйованих клітинах мікроорганізмів. Це пояснюється декількома
причинами. По-перше, з розвитком методів, значно збільшилась швидкість
одержання пептидів, в хімічному синтезі білків спосте-рігається явний прогрес. По-друге, ці методи є досить
корисні для одержання мічених пеп-тидів і аналогів пептидів, які містять модифіковані
амінокислоти або D-амінокислоти. У 1979 році
Йінг і Гійємен синтезували таким способом аналоги і антагоністи 10-членного
пептида, рилізінг-фактора лютеінізуючого гормона (ЛГ-РФ), провівши в шостому
поло-жені заміну на D-амінокислоту і замінивши N-кінцеву
амінокислоту. Це дозволило одер-жати
речовини, що володіють активністю, що в 100 раз перевищує активність природ-нього гормону, і інші речовини, які викликають ефект,
протилежний дії гормону. За допо-могою хімічної модифікації ЛГ-РФ, який призводить до
утворення в першому і другому положенні залишків D-фенілаланіну, і введення в
шостому положенні залишка трипто-фану Кой
(Університет Тулана в Нью-Орлеані, шт. Луізіана) у 1979 році одержав
антаго-ніст ЛГ-РФ, який пригноблював овуляцію у щурів. По активності антагоніст
в 30 раз перевершував з’єднання, одержані тією ж групою вчених трьома роками
раніше.
Гормони
тімуса вигідніше отримувати в
генетично сконструйованих бактеріальних клітинах, ніж шляхом хімічного синтезу. Тімопоетін побудований із 49
амінокислот, проте пентапептид, що входить в його склад, володіє біологічною
активністю, характерною для всієї молекули. Сировотковий фактор тімуса
(СФТ), що складається із 9 амінокислот, вперше був виділений із сиворотки крові
свині, а потім із сиворотки людини; пізніше виявлений у епітелії тімуса
(дослідження Баха в парижській лікарні Неккера). в-ендорфін – опіат мозку, який
складається з 31 амінокислоти, - був синтезований в генетично скон-струйованих
клітинах кишкової палички. У 1980 році австралійський вчений Шайн
(Наці-ональний університет в Канберре), американці Феттес, Лен, Бакстер
(лабораторія Медич-ного університету, Сан-Франциско) і Роберс (Коледж терапії і
хірургії Колумбійського університету, Нью-Йорк) успішно клонували ДНК, яке
кодує в-ендорфін, в клітинах E.coli і одержали цей поліпептид у формі
злитного білку з ферментом в-галактозідази. На пер-шому етапі дослідники
клонували фрагмент ДНК, одержаний в результаті зворотньої тра-нскрипції мРНК
кодуючий більш крупний білок - попередник, який окрім послідовності в-ендорфіну
містить послідовності кортикотропіну (АКТГ) і в-ліпотропіну (в-ЛТГ). Цей
фрагмент ДНК кодував амінокислоти 44-90 в-ЛТГ, які відповідають 15 С-кінцевим
амі-нокислотам D-меланоцитстимулюючого
гормону (МСГ), і повну послідовність в-ендо-рфіна, за виключенням С-кінцевого
залишку глутаміну. Тому перед тим, як вбудувати цей фрагмент ДНК в хромосому
кишкової палички за геном в-галактозідази, потрібно було змінити його таким
чином, щоб в кінці послідовності розміщувався кодон глутаміну, а за ним
послідував стоп-кодон. В-ендорфін, одержаний із гібридного білку і очищений,
во-лодів біологічною активністю, властивою ендорфінам, і специфічно взаємодіяв
з анти-сивороткою проти в-ендорфіна. Разом із тим він відрізнявся від
в-ендорфіну людини по двох амінокислотах. Цю різницю можна усунути, змінивши
два кодона в ДНК бактері-альній плазміді. Заміни в інших кодонах могли призвести до утворення
подібних в-ендо-рфінів з
активністю аналогів чи антагоністів.
Одержання інтерферонів.
Використання
методів генної інженерії для виробництва біологічно активних речовин, які
застосовуються при лікуванні спадкових захворювань і відхилень від норми, передбачає
необхідність медико-біологічних досліджень з акцентом на молекулярну біологію і
біологію клітини як в сьогоденні, так і в перспективі. Вивчення процесів на
молекулярному і клітинному рівнях має першочергове значення, оскільки дозволяє
глибше зрозуміти біологію і фізіологію людини в нормі і при паталогії. Ліку-вальні
речовини можуть бути одержані в живих організмах (а не шляхом хімічного син-тезу), в генетично сконструйованих клітинах бактерій чи
еукаріотичних організмах. Тим самим вони є продуктами метаболізму клітин, а не екзогенними
з’єднаннями, які вико-ристовуються
емпірично і в деяких випадках викликають в клітині реакції, які зводять нанівець мету їх застосування. Прикладом подібного роду таких
з’єднань є інтерферони, які виділяються спеціалізованими клітинами і швидко
блокують зараження клітин віру-сами,
а також антитіла, які утворюються у відповідь на присутні в організмі антигени.
Вперше
інтерферон був одержаний в 1957 році Айзексом і Лінденманном в Націо-нальному інституті медичних досліджень, поблизу Лондона.
Цей білок, який в дуже малих
кількостях виділяється клітинами тварин і людини при введенні в організм вірусу, пред-ставляє
собою першу лінію оборони проти вірусної атаки. Дослідження показали, що інтерферон сприяє виліковуванню
таких захворювань, як простуда, гепатит і лишай. Ок-рім підсилення дії на імунітет інтерферон пригнічує
розмноження аномальних клітин, чим і пояснюється його протипухлинна дія.
Інтерферон утворюється не тільки в
організмі людини, але і в багатьох інших хребет-них, проте володіє видовою
спецефічністю, і тому інтерферон тварин не вдається вико-ристати для лікування
людини. В організмі людини виробляється декілька класів інтер-ферону:
лейкоцитарний (а), фібробластний (в-інтерферон, зручний для широкого
вироб-ництва, оскільки фібробласти на відміну від лейкоцитів розмножуються в
культурі) і імунний (у) із Т-лімфоцитів. Клінічним дослідженням ефективності
інтерферонів переш-коджав низький вихід цих речовин при звичайних методах,
тобто переважно із крові. Так, у 1978 році
Кантелл і його співробітники в Центральній лабораторії охорони здоров’я в
Хельсінкі переробили
Контрольнi
запитання:
1. Якi об’єкти дослiдження в бiотехнологiї?
2. Охарактеризуйте кожного з них. 3. Яке зна-чення має кожен із обєктів
біотехнології? 4. Якi основні методи використовуються в бiотех-нологiї? 5.
Охарактеризуйте кожного з них. 6. Спосiб перенесення генiв у генетичний
апарат тва-рини. 7. Методи бiотехнологiї в землеробствi?