Лекція 3.
ОСНОВИ БІОТЕХНОЛОГІЧНИХ ВИРОБНИЦТВ (доповнено)
План:
3.1. Технологічні процеси в
біотехнології
3.2. Елементи біотехнологічних процесів
3.3.Критерії оцінки ефективності біотехнологічних
процесів
3.4. Контроль і управління
біотехнологічними процесами. Їх моделювання та оптимізація
3.1. Схеми технологічних процесів в біотехнології
Найважливішим завданням будь-якого
біотехнологічного процесу є розробка
і оптимізація науково-обгрунтованої технології і апаратури для нього. При організації
біотехнологічних виробництв частково запозичений досвід розвиненої на той час
хімічної технології. Проте
біотехнологічні процеси мають істотну відмінність від хімічних внаслідок того, що в
біотехнології використовують складнішу
організацію
матерії – біологічну. Кожен біологічний об'єкт (клітина, фермент і т. д.) – це автономна саморегульована
система.
Природа
біологічних процесів складна і далеко не з'ясована. Для мікробних популяцій,
наприклад, характерна істотна гетерогенність
по ряду ознак – вік, фізіологічна активність
стійкість
до дії несприятливих чинників середовища. Вони також схильні до випадкових мутацій,
частота яких становить від 10-4 до
10-8.
Гетерогенність також може бути обумовлена наявністю поверхнового розділу фаз і
неоднорідністю умов середовища.
У загальному вигляді будь-який біотехнологічний
процес включає три основні стадії: передферментаційну, ферментаційну і
постферментаційну. Принципова схема реалізації біотехнологічних процесів в
загальному вигляді може бути представлена блок-схемою, в якій зроблена спроба охопити всі варіанти
процесів ферментацій (рис.3.1.1…3.1.2).
На стадії передферментації зберігають і
проводять підготовку культури продуцента (інокулята), отримання і підготовку
поживних субстратів і середовищ, апаратури для ферментації, технології і води,
що рециркулює, і повітря. Підтримка і підготовка чистої культури є дуже
важливим моментом передферментаційної стадії, оскільки продуцент, його
фізіолого-біохімічні характеристики
і
властивості визначають ефективність всього біотехноло-гічного процесу. У
відділенні чистої культури зберігають виробничі штами і забезпечують їх
реактивацію і напрацювання інокулята
у
кількостях, необ-хідних для початку технологічного процесу. При вирощуванні
посівних доз інокулята застосовують принцип масштабування, тобто проводять
послідовне нарощування біомаси продуцента в колбах, бутилях, в серії
послідовних ферментаторів. Кожен подальший
етап
технологічного процесу відрізняється за об'ємом від попереднього зазвичай на порядок. Отриманий інокулят по
стерильній посівній лінії в подальшому направляється в апарат, в якому
реалізується стадія ферментації.
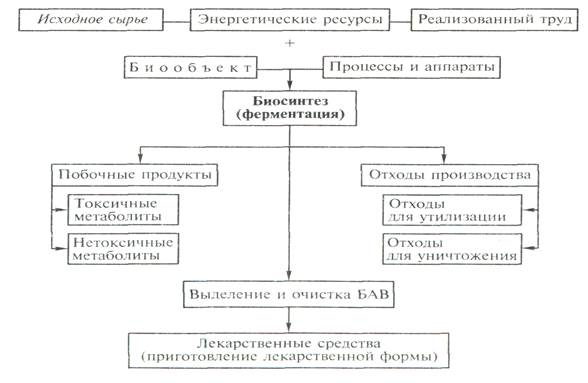
Рисунок 3.1.1. Загальна схема
біотехнологічного виробництва
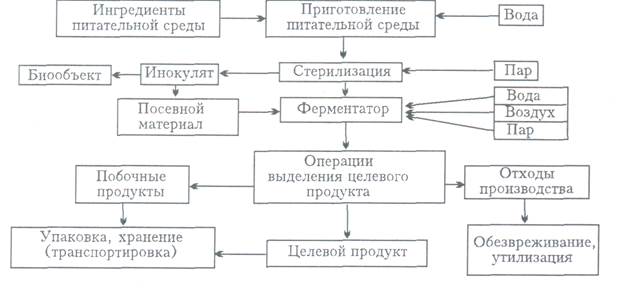
Рисунок 3.1.2. Загальна схема
біотехнологічного процесу
Приготування живильних середовищ
проводять в спеціальних реакторах, обладнаних мішалками. Залежно від
розчинності і місткості компонентів середовищ можуть бути застосовані окремі
реактори. Технологія приготу-вання середовищ значно ускладнюється, якщо в їх склад входять нерозчинні
компоненти. У біотехнологічних процесах застосовуються різні за походжен-ням і
кількістю субстрати, тому процес їх приготування різний. Дозування живильних
компонентів підбирається і проводиться індивідуально на кож-ному виробництві
відповідно до технологічного регламенту конкретного процесу ваговим і об'ємним
обладнанням яке використовується в харчовій і хімічній промисловості. Транспорт
речовин проводять насосами,
стрічкови-ми і шнековими транспортерами.
Сипучі
компоненти подають у фермента-тори за допомогою вакуумних насосів. Часто
застосовують принцип попередніх сумішей, тобто солі заздалегідь розчиняють і
транспортують по трубопроводах дозуючи
їх подачу за об'ємом. Різноманітність біотехнологічних процесів і вживаних для
їх реалізації середовищ, методів і апаратури пов'язаний з конкретними біотехнологічними
виробництвами.
Стадія ферментації є основною в
біотехнологічному процесі, оскільки в її ході відбувається взаємодія продуцента
із субстратом і утворення
цільових продуктів (біомас, ендо -і екзопродуктів). Ця стадія проходить в
біохіміч-ному реакторі (ферментері) і може бути організована залежно від
особ-ливостей продуцента і вимог до типу і якості кінцевого продукту різними способами. Ферментація
може проходити в строго асептичних умовах і без дотримання правил стерильності
(так звана «незахищена»
ферментація); на рідких і на твердих середовищах; анаэробно і аеробно (рис. 3.1.3).
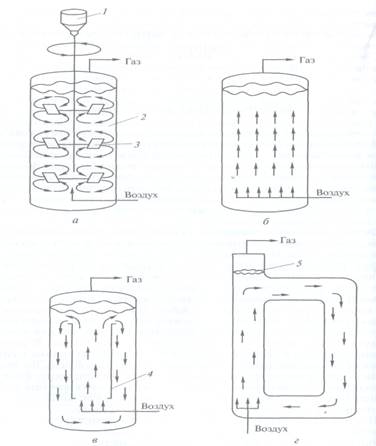
Рисунок 3.1.3. Типи ферментаторів
(реакторів):
де: а – ферментатор з механічним перемішуванням; б – барботажна колонка; в
– ерліфтний ферментатор з внутрішньою рециркуляцією; г - ерліфтний ферментатор з
зовнішньою системою рециркуляції; 1 –
гіотор; 2 – культуральне середовище; 3 – лопасті; 4 – центральна труба; 5 –
газорідинний сепаратор; стрілками показано напрямок потоку культурального
середовища
Аеробна ферментація, у свою чергу, може
протікати поверхнево
або глибинно (у всій товщі живильного середовища). Культивування біологічних
об'єктів може відбуватися в періодичному
і проточному режимах, періодично з підживленням субстрату. При періодичному способі культивування ферментер заповнюється початковим
живильним середовищем і інокулятом мікроорганізмів.
Протягом певного періоду в аппараті
проходить взаємодія мікроор-ганізмів і субстрату. Біохімічні перетворення
продовжуються від десятків годин до декількох діб. Регулювання умов всередині
ферментера – найважливіше
завдання періодичного культивування мікроорганізмів. У ході періодичної ферментації
вирощувана культура проходить ряд
послідовних
стадій: лагфазу, експоненціальну, уповільнення росту, стаціонарну і відмирання. При
цьому відбуваються істотні зміни фізіологічного стану біооб'єкту, а також ряду
параметрів живильного середовища.
Цільові продукти утворюються в експоненціальній (первинні метаболіти – ферменти,
амінокислоти, вітаміни) і стаціонарною (вторинні метаболіти – антибіотики)
фазах, тому залежно від цілей біотехнологічного процесу в сучасних промислових
процессах застосовують принцип диференційованих режимів культивування, в
результаті чого створюються умови для максимального виходу продукції цільового продукту. Періодично ферментер
опорожняють, проводять виділення і очищення продукту, розпочинаючи новий цикл виробництва.
Безперервний процес культивування
мікроорганізмів володіє істотними
перевагами перед періодичним. Безперервна ферментація відбувається в умовах
сталого режиму, коли мікробна
популяція і її продукти найбільш однорідні. Застосування безперервних процесів
ферментації створює умови для ефективного
регулювання
і управління процесами біосинтезу. Системи безперервної ферментації можуть бути
організовані за принципом повного витіснення або повного замішення. Перший
приклад – так звана тубулярна культура.
Процес ферментації відбувається в довгій
трубі, в яку з одного
кінця безперервно поступають живильні компоненти і інокулят, а з іншою з тією ж
швидкістю витікає культуральна рідина.
Така
система проточної ферментації є гетерогенною.
При безперервній ферментації у
ферментаторах повного замішення (гомо-генно-проточний спосіб) у всій масі
апарату ферментації створюються одна-кові умови. Застосування таких систем
ферментації дозволяє ефективно управляти окремими стадіями, а також всім біотехнологічним
процесом, стабілізуючи продуцент в практично будь-якому потрібному експеримента-тору
або біотехнологу стані. Управління подібними установками здійсню-ється двома
способами
Турбідостатній спосіб базується на
вимірюванні каламутності виходящо-
го
потоку. Вимірювання каламутності мікробної суспензії, викликане ростом
клітин і є мірою швидкості росту, з якою
мікроорганізми виходять
з біореактора, що дозволяє регулювати швидкість поступлення у ферментатор
свіжого живильного середовища. Другий метод контролю – хемостатний. Управління
процесом в хемостаті здійснюється
вимірюванням
потоку, що не виходить, а входить. При цьому концентрацію одного з компонентів
живиль-ного середовища (вуглець, кисень, азот), що надходить у ферментатор,
встановлюють на такому рівні, при якому
інші
живильні компоненти знахо-дяться в надлишку, тобто лімітуюча концентрація
біогенного елементу, що задається, обмежує
швидкість
розмноження клітин в культурі.
Забезпечення процесу ферментації, з погляду
інженерної реалізації, зводиться до дозованого надходження у ферментатор
потоків (інокулята, повітря, або
газових сумішей, живильних біогенів, піногасників) і відведен-ня з нього тепла,
відпрацьованого повітря, культуральною
рідиною,
а також вимірюванням і стабілізацією основних параметрів процесу на рівні,
потрібному для оптимального розвитку продуцента і утворення цільового продукту.
В ході ферментації утворюються складні
суміші,
що містять клітини, позаклітинні метаболіти, залишкові концентрації початкового
субст-рату. При цьому цільові продукти, як правило, знаходяться в цій суміші в
невеликих концентраціях, багато з них
легко
руйнуються. Все це накладає істотні обмеження на методи виділення і сушіння біологічних препаратів.
Постферментаційна стадія забезпечує
отримання готової товарної про-дукції та знешкодження відходів і побічних продуктів. Залежно
від локалізації кінцевого продукту
(клітина
або культуральна рідина) і його природи на постферментаційній стадії
застосовують різну апаратуру і методи виділення і очищення. Найбільш трудомістке виділення продукту, що
накопичується в клітинах.
Першим етапом постферментаційної стадії є фракціонування культуральної рідини і
відділення зваженої фази – біомаси. Найбільш поширений для цих цілей метод –
сепарація, яка проводиться в
спеціальних апаратах – сепараторах, які працюють за різними схемами залежно від
властивостей культуральної рідини.
Основні проблеми, виникають при
необхідності виділення дрібнозва-жених частинок
0,5–1,0 мкм і менше (бактеріальні клітини) і необхідністю переробки
значних обємів рідини (виробництво кормового білку, ряду амінокислот). Для підвищення ефективності
процесу сепарації застосовують попередню спеціальну обробку культури – зміна
рН, нагрівання, додавання хімічних агентів. Для збільшення термінів придатності
біотехнологічних продуктів проводять їх обезводнення і стабілізацію. Залежно
від властивос-тей продукту застосовують різні методи висушування. Сушка термостабіль-них
препаратів здійснюється на підносах
стрічковому
конвеєрі, а також в киплячому шарі. Особливо чутливі до нагрівання препарати висушують
у вакуум-сушильних шафах при зниженому
тиску і температурі. До стабілі-зації властивостей біотехнологічних продуктів
призводить додавання в якості наповнювачів різних речовин (для стабілізації
кормового білку
застосовують пшеничні висівки, кукурудзяну муку, що володіють високою поживною цінністю. Для
стабілізації ферментних препаратів
використовують гліцерин і вуглеводи, які перешкоджають денатурації ферментів, а
також неорганічні іони кобальту, магнію,
натрію,
антибіотики і ін.
3.2. Елементи біотехнологічних процесів
Основними елементами, що складають
біотехнологічні процеси є:
біологічний агент, субстрат, апаратура і продукт.
Біологічний агент є активним початком в
біотехнологічних процесах і одним з найбільш важливих її елементів.
Номенклатура біологічних
агентів розширюється, але в даний час найважливіше місце займає
традиційний об'єкт – мікробна клітина
(табл. 3.2.1, 3.2.2).
Таблиця 3.2.1. Мікрооорганізми, використовувані в
промисловості
для отримання цільових продуктів
|
Організм |
Тип |
Продукт |
|
Saccharomyces
cerevisiae |
Дріжджі |
Пекарні дріжджі, вино, ель, саку |
|
Streptococcus
thermophilus |
Бактерії |
Іогурт |
|
Propionibacterium
shermanii |
Бактерії |
Швейцарський сир |
|
Gluconobacterium
suboxidans |
Бактерії |
Оцет |
|
Penicillium
roquefortii |
Цвіль |
Сири типу рокфору |
|
Aspergillus
oryzae |
Цвіль |
Саку |
|
Saccharomyces
cerevisiae |
Дріжджі |
Етанол |
|
Clostridium
acetobutylicum |
Бактерії |
Ацетон |
|
Xanthomonas
campestris |
Бактерії |
Полісахариди |
|
Xanthomonas
campestris |
Бактерії |
Полісахариди |
|
Corynebacterium
glutamicum |
Бактерії |
L-лизин |
|
Candida
utilis |
Дріжджі |
Мікробний білок |
|
Propionibacterium |
Бактерії |
Вітамін В12 |
|
Aspergilus
oryzae |
Цвіль |
Амілаза |
|
Kluyveromyces
fragilis |
Дріжджі |
Лактаза |
|
Saccharomycopsis
lipolytica |
Дріжджі |
Ліпаза |
|
Bacillus |
Бактерії |
Протеази |
|
Endothia
parasitica |
Цвіль |
фермент Сичужний |
|
Leocanostoc
mesenteroides |
Бактерії |
Декстран |
|
Xanthomonas
campestris |
Бактерії |
Ксантан |
|
Penicillium
chrysogenum |
Цвіль |
Пеніцилліни |
|
Chehalosporium
acremonium |
Цвіль |
Цефалоспіріни |
|
Rhizopus
nigricans |
Цвіль |
Трансформація стероїдів |
|
Гибрідоми |
– |
Імуноглобуліни і моноклональні антитіла |
|
Клітинні
лінії ссавців |
– |
Інтерферон |
|
E.coli
(рекомбінантні штами) |
Бактерії |
Інсулін, гормон росту, інтерферон |
|
Blakeslea
trispora |
Цвіль |
?-Каратин |
|
Phaffia
rhodozyma |
Дріжджі |
Астаксантін |
|
Bacillus
thuringiensis |
Бактерії |
Біоінсектициди |
|
Bacillus
popilliae |
Бактерії |
Біоінсектициди |
Таблиця 3.2.2. Найважливіші групи субстратів, біологічних
агентів і
утворюваних в біотехнологічних процесах продуктів (по Вієстур і ін., 1987).
|
Субстрати |
Біологічні агенти |
Продукти |
|
Меляса,
сік цукрової тростини, гідролізат рослинних полімерів. |
Мікроорганізми,
рослинні і тваринні клітини, і позаклі тинні продукти. |
Біодобрива
і біоінсектициди, мікробна біомаса |
|
Цукри,
спирти, органіч-ні
кислоти. |
Віруси. |
Біогаз. |
|
Парафіни
нафти, напів-продукти, попередники
біотрансформації |
Компоненти
клітин: мемб рани, протопласти,
мітохо-ндрії, ферменти. |
Чисті
продукти діагностіку ми |
|
Органічні
кислоти. Природний
газ, водень. |
Іммобілізовані
клітини мікроорганізмів, рослин, тварин та їх компоненти, білок
одноклітинних. |
Поліцукри. |
|
Відходи
сільського гос-подарства і лісової
про-мисловості. |
Органічні розчинники |
Харчові
продукти. Екстракти, гідролізат. |
|
Відходи
промисловості,
переробки фруктів і овочів. |
|
Спирти |
Мікробні клітини з різними
хіміко-технологічними властивостями можуть бути виділені з природних джерел з
допомогою традиційних
(селекція, відбір) і новітніх методів (клітинна і генетична інженерія) істотно
модифікованих. При виборі
біологічного агента і постановці його на виробництво перш за все слід
дотримуватися принципу технологічності штамів. Це означає, що мікробна клітина, популяція
або співтовариство особин повинні зберігати свої основні фізіолого-біохімічні
властивості в процесі тривалого проведення ферментації. Промислові продуценти
повинні володіти стійкістю до мутаційних змін, фагам, зараженню сторонньою
мікрофлорою (контамінації); характеризуватися безпечністю для людей і
навколишнього середовища, не мати при вирощуванні побічних токсичних продуктів обміну і відходів, мати високі
виходи продукту і прийнятні
техніко-економічні показники.
В даний час багато промислових мікробних
технологій базуються на використанні гетеротрофних організмів, а в майбутньому
вирішальне місце серед продуцентів займуть їх автотрофні форми, що не мають потреби для росту
в дефіцитних органічних середовищах, а також
екстремофіли
– організми, що розвиваються в екстремальних умовах середовища (термо-фільні,
алкало -і ацидофільні).
Останніми роками розширюється
застосування змішаних мікробних культур і їх природних асоціацій. В порівнянні
з монокультурами мікробні
асоціації здатні асимілювати складні, неоднорідні по складу субстрати, які
мінерализують складні органічні зєднання, маючи підвищену здатність до
біотрансформації, володіють підвищеною стійкістю до несприятливих чинників
середовища і токсичних
речовин, а також підвищену продуктивність і можливість обміну генетичною інформацією
між окремими видами співтовариства. Основні галузі застосування змішаних
культур – охорона навколишнього
середовища, біодеградація.
Особлива група біологічних агентів в
біотехнології – ферменти так
звані каталізатори біологічного походження. Вони знаходять все більше
застосу-вання в різних біотехнологічних процессах і галузях народного
господарства.
Як окрему галузь у створенні і
використанні нових біологічних агентів виділяють іммобілізовані ферменти, які є гармонійно функціонуючою
систе-мою, впливом яким
визначається правильний вибір ферменту, носія і способу
іммобілізації.
Перевага іммобілізованих ферментів у порівнянні з розчинни-ми полягає в стабільності і підвищенні
активності, утримання в об'ємі реактора, можливість повного і швидкого
відділення цільових продуктів і організації безперервних процесів ферментації з
багаторазовим використан-ням біологічного агента. Іммобілізовані ферменти відкривають нові можливості в
створенні біологічних
мікропристроїв для використання в аналітиці, перетворенні енергії і
біоелектрокаталізі.
До нетрадиційних біологічних агентів на
даному етапі розвитку біотех-нологію
відносять рослинні і тваринні тканини, зокрема гібридоми, трансплантанти.
Значна увага приділяється отриманню
новітніх біологічних агентів – трансгенних клітин мікроорганізмів, рослин,
тварин генноінженер-них методів. Развиваючи нові методи, що дозволяють
отримувати штучні клітини з використанням
синтетичних і біологічних матеріалів
(мембрани
із заданими властивостями, ізотопи, магнітні матеріали, антитіла).
Розроб-ляються підходи до конструювання ферментів із заданими властивостями, що
мають підвищену реакційну активність і
стабільність.
Таким чином, в біотехнологічних процесах
можливе використання біоло-гічних агентів з різним рівнем організації від
клітинної до молекулярної.
З розвитком промислових процесів
відбувається накопичення відходів, які можуть бути знешкоджені і конвертовані в
корисні продукти методами
біотехнології. Як джерела вуглецю і енергії в
біотехнологічних процесах використовують головним чином природні комплексні середовища невизна-ченого
складу (відходи різних виробництв, продукти переробки рослинної сировини,
компоненти стічних вод і ін.), у
яких
крім вуглецевих з'єднань містяться і мінеральні елементи. Широко використовуються як біотехноло-гічні
субстрати целюлоза, гідролізат поліцукри і
деревина.
Останні близько 30 років використовують для отримання білку. Кислотний гідроліз
деревини при 175–190°С забезпечує вихід в середньому до 45–50% редукуючих
речовин; при жорсткіших режимах
гідролізу він зростає до 55–68%. Високу
ефективність виробництва білку забезпечує використання гідролізату торфу, що
дозволяє понизити вартість препаратів
(амінокислот) в 4–5 разів.
Мінеральні елементи, які необхідні для росту біологічних агентів і які
входять до складу живильних середовищ, поділяються на макро -і мікроеле-
менти.
Серед макроелементів на першому місці займає азот, оскільки потреба в ньому у біологічних об'єктів на порядок
перевищує потребу в інших елементах (фосфорі, сірці, калії і магнії).
Азот
зазвичай
використовується мікроорганізмами у відновленій формі (сечовина, амоній або їх
солі). Часто він вводиться в комплексі з іншими макроелементами – фосфором, сіркою, джерелами яких є солі (сульфати або фосфати
амонію). Для окремих продуцентів
кращими є нітрати або органічні з’єднання
азоту. Істотне значення при забезпеченні азотного живлення продуцента має не
тільки вид, але концентрація азоту в середовищі, оскільки зміна співвідношення
C:N, впливає на швидкість росту продуцента, метаболізм, викликає надсинтез ряду
цільових продуктів (амінокислот, поліцукрів і ін.). Мінеральні елементи
необхідні для росту
будь-якого біологічного агента, проте їх концентрація в середовищі в залежності
від біології біооб'єкту і завдань біотехнологічного процесу різна. Так,
концент-рація макроелементів в середовищі (K,Mg, P,
S) зазвичай становить близько 10–3–10–4 М. Потреба в мікроелементах незначна, а
їх концентрація в середовищах істотно нижча – 10–6–10–8 М, тому мікроелементи
часто спеціально не вносять в середовище, оскільки їх присутність в основних
солях і воді забезпечують необхідну потребу продуцентів. Окремі продуцен-ти
через специфіку метаболізму або потребу в поживних елементах вимагають
присутності регуляторів росту (окремих амінокислот, вітамінів і ін.). Крім
чистих індивидуальних речовин такої природи, на практиці часто використовують в якості регуляторів
кукурудзяний або дріжджовий екстракт, картопляний сік, екстракт проростків
ячменю, відходів зерна і молочної
промисловості. Їх стимулююча дія багато в чому залежить від індиві-дуальних
властивостей продуцента,
складу основного середовища, умов ферментації і ін. Введення в склад живильного
середовища регуляторів росту збільшує вихід цільового продукту, наприклад ферментів, в десятки
разів.
Традиційно склад живильного середовища,
оптимального для біотехно-логічного процесу, визначається методом тривалого
емпіричного підбору,
в ході якого на перших етапах визначається його якісний і кількісний склад. Проведено
багато спроб обгрунтування складу
живильного середовища з позиції фізіології і біохімії продуцента, але оскільки потреби в елементах живлення
видо -і навіть штаммоспецифічні, у
кожному випадку доводиться підбирати оптимальний для конкретного продуцента
склад середовища. В останні 20–25 років використовують математичний метод
планування експериментів, математичне моделювання біотехнологічних процесів, що
з економічної точки зору дозволяє
обгрунтовано
підходити до підбору живильних середовищ.
Апаратура.
Питаннями технічного забезпечення біотехнологічних процесів займається
біоінженерія. Для різних процесів необхідна величезна різноманітність
апаратури: власне для процесу ферментації,
а також для виділення і отримання готового продукту.
Найбільш складна і специфічна апаратура
для стадії ферментації. Тех-нічно
найбільш складним процесом ферментації є аеробний глибинний стерильний і
безперервний (або з підживленням субстратом). Апарати для поверхневої і
анаеробної ферментації менш складні
і енергоємні. У сучасній літературі описані біореактори, що відрізняються по
конструкції, принципу роботи і розмірах (від
декількох
літрів до декількох тисяч кубометрів).
Численність методів культивування,
надзвичайне різномаїття використо-вуваних
біологічних
агентів призвели до різноманітності конструктивних рішень, які залежать від:
типу продуцента і середовища, технології і масш-табів виробництва, цільового продукту і ін. Технічне оснащення
біотехноло-гії базується на загальних положеннях технічної біохімії і харчової
технології, проте має свою специфіку.
Принципова відмінність біотехноло-гічних процесів від чисто хімічних полягає в
наступному:
– чутливість біологічних агентів до
фізико-механічного впливу;
– наявність міжфазового перенесення речовин
(за типом «рідина – кліти-на», «газ – рідина – клітина»);
– вимоги умов асептики;
– низька швидкість протікання багатьох
процесів в цілому;
– нестабільність цільових продуктів;
– піноутворення;
– складність механізмів регуляції росту і
біосинтезу.
Найбільш поширеними типи апаратів - ферментерів, які промислово випускаються є:
Апарати
для анаеробних процесів достатньо прості і найбільше засто-сування набули в процесах конверсії рослинної
сировини, зокрема рослинних відходів,
а також різних промислових відходів. При метановому бродінні для отримання
біогазу, а також у ряді інших процесів (отримання ацетону, шампанських вин)
використовують апарати ферментатори (метан-тенки) різної конструкції (від
простої вигрібної ями до складних
металевих конструкцій або залізобетонних споруд) з об'ємом (від декількох до
сотень кубометрів). Метанові установки обладнані системою подачі сировини, системою теплообміну труб для
стабілізації температури, нескладним
перемішуючим
пристроєм для гомогенного розподілу сировини і біомаси продуцента, газовим ковпаком і пристроєм змінного об'єму (газгольдер) для збору
біогазу (рис. 3.2.3).
Конструкція апаратів для аеробної
ферментації визначається типом фер-ментації і сировини. Апарати для аеробної
поверхневої ферментації, широко вживані для виробництва органічних кислот і ферментів, достатньо прості по
конструкції і, відповідно, поділяються на рідко –і твердофазні. Поверхнева
рідкофазна ферментація
протікає в так званих бродильних вентильованих ка-мерах, в яких на стелажах розміщені плоскі металеві
кювети в які наливають рідке живильне середовище, висотою 80–150 мм, потім з
потоком повітря, що подається, середовище інокулюють спорами продуцента. У
камері стабілізується вологість, температура і швидкість подачі повітря. Після
завершення процесу культуральна рідина зливається з кювет через вмонтова-ні в
днища штуцера і
поступає на переробку. При твердофазній ферментації процес також протікає у вентильованих
камерах, але замість кювет на стелажах встановлюють лотки, в які насипають
сипуче тверде середовище шаром 10–15мм. Для кращої аерації середовища повітря,
що подається в камеру, проходить
через
перфороване днище лотків.
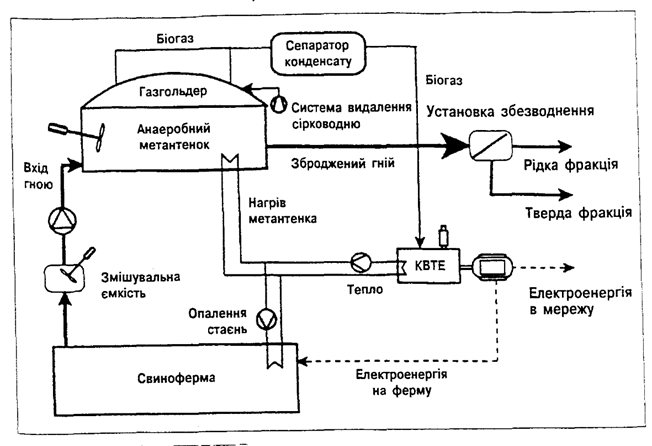
Рисунок 3.2.3. Схема роботи метанової установки.
Апарати для аеробної глибинної ферментації найбільш складні як конст-руктивно, так і з
погляду їх експлуатації. Головне завдання
що
виникає при їх конструюванні, – забезпечення високої інтенсивності массо -і
енергообміну клітин із середовищем. Масообмін визначається транспортом (перенесенням)
кисню і інших біогенних елементів із середовища в мікробну клітину і
відведенням з неї продуктів обміну. Головним
показником
массообмінних характеристик ферментатора служить коефіцієнт массопередачі
кисню, оскільки він є основним лімітуючим чинником аеробних процесів
фермен-тацій. Витрата кисню
на утворення
В даний час розроблено і застосовується
значна кількість різноманітних перемішуючих і аеруючих пристроїв, і
класифікувати їх практично немож-ливо. Найбільш вдала, спроба класифікації
апаратів - ферментаторів для аэробної глибинної ферментації по підведенню
енергії (Вієстур і ін., 1986;
1987).
Згідно цієї класифікації, апарати такого типу поділяються на три групи по підведенню енергії:
до газової фази, до рідкої фази, комбіноване підведення.
Ферментатори
з підведенням енергії до газової фази (група ФГ). Їх зага-льна ознака – підведення
енергії в апарат через газову фазу, яка
є
її носієм. Ферментатори характеризуються достатньо простою конструкцією
(відсутні вузли, що труться, рухомі), високою експлуатаційною надійністю, але
мають не дуже високі массообмінні
характеристики
(коефіцієнт массопередачі кисню менше 4 кг/м3). Дані апарати є вертикальною
ємкістю забез-печену газорозподільним
пристроєм одного з відомих типів.
Барботажні газо-розподільні пристрої зазвичай встановлюються в нижній частині
апарату. Пройшовши розподільною трубою через барботер, кисень насищує товщу
середовища. Коефіцієнт масопереносу кисню при цьому невисокий, 1–2 кг/м3/ч; барботажно-колонний – в нижній
частині корпусу такого апарату встановлюється перфорована пластина з діаметром
отворів
Ферментатори
з введенням енергії рідкою фазою (група ФЖ) найбільш складні по конструкції
і енергоємні, проте забезпечують найбільш високі в порівнянні з групою
ферментаторів ГФ коефіцієнта масопередачі
кисню, понад 6 кг/м3/ч. У даних апаратах введення енергії
здійснюється рідкою фазою, зазвичай самовсмоктуючими мішалками або насосами; в
останньому варіанті рідина вводиться в апарат через спеціальний пристрій
(сопло, ежек-тор, диспергатор). Дані аппарати поділяють на типи: ферментатори з
самовсасуючими мішалками не вимагають спеціальних повітродувних ма-шин, оскільки надходження в
них повітря відбувається в результаті розрід-ження в повітряній камері мішалки,
сполученої з повітроводом і з рідиною,
відкиданої лопатками мішалки; у ежекційних ферментаторах можлива рециркуляція
газової фази, що економить субстрат, однак необхідна наявність спеціальних насосів для
перекачування газовмісного
культураль-ного середовища. Застосування ежекційного введення газових
субстратів у ферментатор може інтенсифікувати масообмін на порядок; струменеві ферментатори (із
затопленим або падаючим струменем) обладнуються могут-німи насосами, які забирають культуральну
рідину з нижньої частини апарату і через напірний трубопровід підводять потік
до аеруючого пристрою (за типом шахтного перепаду або напірно-струменеві). Струмінь рідини під тиском
вільно падає зверху і пронизує рідину,
що аерується, до дна апарату, в результаті чого проходить інтенсивна
турбулізація і перемішування рідини. Внизу рідина знов засмоктується насосом і знову подається
вверхню частину апарату, тобто виникає замкнутий контур циркуляції.
Недоліком даних апаратів є втрати енергії при перекачуванні
рідини, труднощі проектування у зв'язку з
відсутністю
надійних методик розрахунку конструкцій і режимів роботи струменевих і ежекційних
пристроїв.
Третя група апаратів – з підведенням енергії газовою і рідкою
фазами (група ФЖГ). Основними їх
конструкційними елементами є перемішуючі пристрої всіх відомих типів, а також
наявність насосів і перемішуючих при-строїв. Це можуть бути апарати з групою
самовсмоктуючих мішалок і насосом для перекачування культуральної рідини,
перемішуючих і
аеруючих пристроїв. Коефіцієнт масопереносу кисню в таких ферментаторах може мати будь-які значення.
Перераховані типи апаратів виникли в
основному протягом «ери» антибіотиків
і білку одноклітинних і застосовуються, головним чином, в технічній мікробіології.
Прогрес в отриманні клітинних і
рекомбінантних культур висуває
спеціальні вимоги до біореакторів. При цьому на перший план висуваються стабільність біологічних агентів, підвищені вимоги до
асептики, лімітація зрізов умов при перемішуванні і ін. Проте, багато з таких
конструкцій поки що
носять експериментальний характер.
Продукти.
Асортимент продуктів, що отримуються в біотехнологічних процесах широкий. За
різноманітністю і об'ємами виробництва на першому місці продукти, що отримують
в процесах, основаних на життєдіяльності мікроорганізмів. Ці продукти
поділяються на три основні групи:
– біомаса, яка є цільовим продуктом
(білок одноклітинних) або вико-ристовується як біологічний агент
(біометаногенез, бактеріальне ви лугову-вання металів);
– первинні метаболіти – це
низькомолекулярні сполуки, необхідні для росту мікроорганізмів як будівельні
блоки макромолекул, коферментів (амінокислоти, вітаміни, органічні кислоти);
– вторинні метаболіти (ідіоліти) – це
з'єднання, не потрібні
для росту мікроорганізмів і не пов'язані з їх ростом (антибіотики, алкалоїди,
гормони росту і токсини).
Серед продуктів мікробіологічного синтезу
– значна кількість різних
біологічно активних з'єднань, зокрема білкових і лікарських речовин, фер-ментів, а також енергоносії (біогаз спирти) і мінеральні ресурси
(метали), засоби для боротьби з шкідниками сільськогосподарських культур
(біоінсек-тициди) і біодобрива. У
зв'язку з розвитком новітніх методів біотехнології (інженерній ензимології,
клітинній і генній інженерії) спектр цільових продуктів безперервно
доповнюється. Серед них все більше
займають
засоби діагностики і лікування (гібридоми, моноклональні антитіла, вакцини і сироватки,
гормони, модифіковані антибіотики).
3.3. Критерії оцінки ефективності
біотехнологічних процесів
При виборі біотехнологічного методу
отримання конкретного цільового продукту
проводиться техніко-економічна оцінка
отримання альтернативних шляхів подібних
продуктів традиційними методами.
В порівнянні з відоми-ми, біотехнологічні процеси повинні бути більш технологічні, економічні і екологічними, або взагалі виключати
альтернативу. Оцінка альтернативності
варіантів
тільки через собівартість продукту – недостатня тому, що крім якості кінцевого
продукту необхідне порівняння результатів
експеримента-льного і теоретичного виходу продукту, розраховані згідно
понесених витрат. При цьому витрати і
вартість сировини в крупномасштабних біотехноло-гічних процесах, як правило є
визначальними, оскільки їх матеріально-енергетична оцінка може бути істотною.
І, навпаки, при використанні процесів на основі високопродуктивних рекомбінантних штамів-продуцентів
основна частка витрат відноситься не
до сировини, а до створення продуцента і його підтримання протягом
технологічного процесу, а також розробці спеціальних умов його культивування,
то в даному випадку економіка сировинних і енергоресурсів відіграє другорядну
роль.
У будь-якому біотехнологічному процесі
ключову роль відіграє біологіч-ний агент, його природа і фізіолого-технологічні
властивості. Для росту будь-якого
біооб'єкту необхідний початковий життєздатний посівний мате-ріал, джерела
енергії і вуглецю, елементи живлення для синтезу біомаси, відсутність дії інгібіторів росту, відповідні
фізико-хімічні умови ферментації (рН, температура, аерація і ін.).
Одним з основних показників, що
характеризують адекватність умов ферментації є швидкість росту продуцента.
Швидкість росту (збільшення
біомаси) організмів з бінарним діленням в добре перемішаному середовищі в
періодичній культурі буде пропорційне
концентрації
мікробної біомаси:
dX/dt
= ?X,
де: dX/dt – швидкість росту, Х – біомаса ? –
коефіцієнт пропорціо- нальності
(«питома швидкість росту»); параметр аналогічний складним
відсоткам (наприклад, якщо питома
швидкість росту рівна 0.1 ч–1, – значить
збільшення біомаси рівне 10% за годину).
Якщо величина ? постійна, як це
буває в сталому режимі культивування, то представлене рівняння має вигляд:
lnX =
lnX0 + ? t
де: Х0 – біомаса в початковий період часу t.
Графік
залежності lnX від часу матиме вид прямої лінії з нахилом ?. Питома швидкість росту є одним з основних
параметрів, що характеризують фізіологічний стан продуцента і ряд інших параметрів може бути
виражений через цей показник.
Продуктивність процесу характеризується
кількістю продукту отрима-ного
на одиницю об'єму біореактора за одиницю часу. Продуктивність процесу залежить
від багатьох чинників: активності продуцента
значень
коефіцієнта виходу продукту із спожитого субстрату кількості активної біомаси у
ферментаторі:
П = qs
Yp/s X [г/л ч.]
де:
qs – швидкість використання субстрату (метаболічний коефіцієнт), Yp/s- вихід продукту (економічний
коефіцієнт), X – концентрація біомаси, P – продукт, S – субстрат.
Впливати на величину продуктивності можна
і шляхом зміни її складових, але у кожному конкретному випадку це доводиться робити окремо. Так, при
підвищенні величини Х можуть виникнути обмеження по масообмінних
характеристиках апарату; впливати на величину метаболічного коефіцієнта культури можливо тільки за
умови глибокого знання взаємо-зв'язків
між
фізіолого-біохімічними характеристиками продуцента і умовами середовища.
Вихід продукту (Y) (економічний
коефіцієнт) визначається як
кількість продукту, що отримується з даної кількості субстрату:
Y =
X/Sо – S
де: S і So – кінцева і початкова концентрація
субстрату.
Даний коефіцієнт виражає ефективність
використання субстрату для отримання цільового продукту і є важливою
характеристикою, оскільки безпосередньо пов'язаний з продуктивністю і дозволяє
безпосередньо впли-вати на собівартість кінцевого продукту. Економічнкий
коефіцієнт має чіткий фізичний сенс, який характеризує ступінь переходу енергії
субстрату в продукт. Дана
величина необхідна для розрахунків і прогнозування процесу в цілому і використовується як
параметр для контролю і управління за ходом
процесів і визначення їх ефективності.
Питомі енерговитрати істотно змінюються
залежно від спрямованості
і схеми процесу ферментації, а також умов підготовки сировини на передфер-ментаційної стадії і
постферментаційних процедур.
Питомі енерговитрати залежать і від типу устаткування процесів
ферментації.
Непродуктивні витрати субстрату (h) – це
витрати енергії субстрату, які відсутні в прирості продукту. В загальному
вигляді вони виражаються
через економічний коефіцієнт:
h =
Yекспериментальний/Yтеоретичний < 1.
Непродуктивні витрати істотно впливають
на ефективність і економіку
біотехнологічного процесу, тому аналіз причин додаткових витрат субстрату
енергії є важливим. Непродуктивні
витрати субстрату можуть бути пов'язані з прорахунками при прочитуванні генетичної
інформації в ході швидкого росту продуцента
і
витратами на підтримку при роздільному рості в результаті зниження ефективності
утворення енергії в ланцюзі перенесення електронів із-за окислення і
фосфорилювання, виникнення
альтернативних, менш ефективних гілок, з дисипацією енергії, а також із-за
росту витрат енергії на підтримку
життя
без розмноження (транспорт субстратів і моно-мерів в клітині, ресинтез молекул,
захисні реакції, процеси репарації).
Первинна оцінка ефективності
біотехнологічних процесів по перера-хованих параметрах проводиться на стадії
лабораторних розробок і випробувань процесу з послідуючим уточненням при
масштабуванні на дос-лідних і
дослідно-промислових стадіях.
3.4. Контроль і управління
біотехнологічними процесами.
Їх моделювання та оптимізація
Ефективне проведення біотехнологічних
процесів повязане із вдоско-наленням способів контролю і
управління. В період становлення в біотехнології робилися окремі спроби
регулювати розвиток продуцента за допомогою змін параметрів зовнішнього
середовища. До середини
ХХ століття регулювання в основному проволилось емпірично, оскільки без
відповідних знань, неможливо ефективно контролиролювати і управляти процесом. В
основному, об'єктом управління того
періоду
була екстенсивна періодична культура мікроорганізмів із всіма її недоліками: динамікою
стану продуцента і середовища та відсутністю засобів контролю. За останні 25
років з впровадженням керованих культур
біотехнологи переходять від вирішення простих завдань, підтримки певних
параметрів середовища до управління процесом в цілому. Для реалізації
керованого культивування необхідна побудова алгоритмів управління, заснованих на
моделях біотех-нологічного процесу. В сучасних біотехнологічних процесах
необхідно реєструвати і
аналізувати безліч чинників, що змінюються (концентрацію субстрата, біомаси і
продукту в культурі, рН, температуру, парціальний тиск кисню і ін.), що
викликає необхідність застосування електронної техніки (табл. 3.4.1)
Таблиця 3.4.1. Величини і розрахункові параметри, вживані
для управління
біотехнологічними процесами
|
Параметри |
Розрахунки на базі вимірювань |
|
Концентрація основних субстратів і
продуктів в культуральному середо-вищі (цукру, спирту,
органічних кислот і ін.). |
Продуктивність
(кг /м3 ч). Питома
швидкість росту ? (ч-1). Питома
швидкість використання субстрату, qs
(кг/кг Х ч). |
|
Концентрації найважливіших
внут-ріклітинних компонентів (ферменти метаболізму (кг/кг Х ч). |
Питома
швидкість утворення продукту, qp
вуглецю, ключові
метаболіти, АТФ НАДФ
і ін.). |
|
Економічний коефіцієнт |
Yp,
Yx (кг/кг). |
|
Концентрація біомас. |
Об'ємний коефіцієнт масопередачі по кисню, Kvp (ч -1). |
|
Склад мікрофлори в культурі. |
|
|
Концентрація розчинених О2 і СО2 в культуральному середовищі. |
Енергетичний вихід біосинтезу ?. |
|
Рівень і стан піни. |
Теплопродукція. |
|
Концентрація цільового продукту |
Сумарна питома витрата сировини. |
Перші розробки по застосуванню ЕОМ в біотехнології
відносяться до кінця 60-х років. ХХ століття. На перших етапах ЕОМ привертали
як порадника оператора, керівника управління механізмами для підтримки
оптимального біотехнологічного процесу. Перш за все, для збору і обробки
інформації за показами датчиків і для представлення цієї інформації у легкодоступній формі.
Розроблялись і системи автоматичного регулювання окремих параметрів (дозування
середовища або окремих компонентів, стабілізація температури і рН середовища,
швидкості протоку)
за принципом контролю із зворотнім зв'язком. Пізніше використовують для управління
технологічним процесом автоматизовані системи АСОВІ. Завдання по ство-ренню
АСОВІ стало особливо актуальним при реалізації великотоннажних біотехнологічних процесів. В даний час АСОВІ
здійснюється на основі системного
підходу,
і управління має багаторівневу ієрархічну систему.
Впровадження АСОВІ дозволяє здійснити
раціональне управління проце-
сом
біосинтезу. В результаті цього економляться початкова сировина, електроенергія,
вода, підвищується продуктивність процесу і продуктивність праці обслуговуючого
персоналу. Витрати на створення і впровадження АСОВІ в біотехнології окуповуються порівняно швидко,
протягом 3–4 років.
Звичайна схема контролю і управління
ферментацією включає фер- ментатор,
датчики, регулюючу систему, яка реалізує розрахункові залеж-ності на основі
вимірювання параметрів процесу. Початкові дані від датчиків поступають на ЕОМ, в якій вони оперативно
аналізуються, видаючи дані
для виконавчих пристроїв і механізмів. В даний час розробка і впровадження
АСОВІ для біотехнологічних процесів, перш за все, визначається рівнем технічної
оснащеності даних процесів і залежить від рівня електронного обладнання,
засобів контролю і автоматизації. Існують і проблеми внаслідок значної
інформаційної ємності біотехнологічних
процесів.
Ефективність АСОВІ залежить від швидкодкості і об'єму памяті ЕОМ. Тому прогрес
в біотехнології залежить від прогресу в
електроніці. Впровадження АСОВІ стримується відставанням у створенні надійної і
швидкодіючої контрольно-вимірювальної
апаратури,
що витримує стерилізацію і задовольняє сучасні вимоги до чутливості і точності
вимірювання, надійності, мініатюризації.
Моделювання є одним з найбільш
перспективних напрямків при
розробці біотехнологічних процесів, оскільки за його допомогою
(експериментально-го і математичного), досліджуються і розробляються нові
технологічні процеси, удосконалюються апарати і технологічні схеми виробництв.
При експериментальному моделюванні в лабораторних і промислових умовах
застосовуються, як правило, моделі
об'єктів
і процесів, що відрізняються масштабами. Експериментальне моделювання дозволяє
досліджувати і оптимізувати процеси, сутність яких мало вивчена. Даний підхід
часто єдиний засіб
для дослідження біотехнологічного процесу.
Першим етапом експериментального
моделювання є лабораторний рівень, в
ході
якого при порівняно невеликих витратах проводиться вивчення
нових
продуцентів і розробка нових процесів. Отримані результати переносять в дослідні, напівпромислові і
промислові масштаби.
На дослідних установках відпрацьовуються технологічні деталі майбутнього процесу,
навчається персонал, розробляється устаткування уточнюються техніко-еко-номічні показники. Потім
проводяться крупномасштабні дорогі промислові експерименти і випробування.
Експериментальне моделювання має ряд особливостей: працеємність, складність
реалізації нової моделі процесу. Най-більш важкі при цьому питання масштабування технології і устаткування.
Розвиток біологічних агентів пов'язаний не тільки з поведінкою
рідини і реагентів у ферментаторі, але і з їх власним метаболізмом. Тому
масштабу- вання
в біології вимагає спеціальних рішень, при цьому до теперішнього часу немає
єдиного підходу до вирішення даної задачі.
Для
оптимізації
і управління біотехнологічними процесами, крім експе-риментального, необхідне залучення
математичного моделювання.
Ці два підходи, доповнюючи один одного, дозволяють більш ефективно вирішувати
поставлені завдання. Експериментальне моделювання часто передує математичному,
будучи для нього джерелом інформації.
Математичні моделі – зручний засіб узагальнення експериментальних даних.
Наявність матема-тичних моделей дозволяє
більш
обгрунтовано підходити до планування експериментів і обробки одержаних даних,
істотно скорочувати об'єм експериментальних робіт. Для моделювання і розрахунку
біотехнологічних процесів застосовують системний підхід. Математична модель -
складна біосистема, яка включає опис різних за своєю природою об'єктів і явищ. Тому,
аналізуючи біологічну систему в цілому, застосовують метод деком-позиції,
розчленовувавши початкову систему на ряд
підсистем:
будуються моделі масообміну, кінетики росту біооб'єкту і біохімічних процесів.
До теперішнього часу розроблено моделі
масообміну, кінетики викорис-тання субстрату і утворення кінцевих продуктів.
Найбільш складне завдання – моделювання власне біологічних об'єктів, оскільки вони значно складніше
хімічних, фізичних і технічних. Об'єкти
біотехнології здатні до саморегулю-вання, їх складність посилюється
неоднорідністю. Процеси, що
протікають в біореакторі, залежать не тільки від складних внутріклітинних
чинників, але і від умов зовнішнього середовища; у свою чергу, зовнішні процеси в біології пов'язані
із внутрішніми, тому їх розділити неможливо. Окрім цього, на даному етапі рівня
розвитку математичної біології відсутня теорія, адекватна суті біологічних
процесів.
Поки не створений математичний апарат,
здатний описати природу біо-логічних
перетворень у всьому різномаїтті, необхідний
розвиток
і вдоско-налення самого математичного апарату. Математичний опис біологічних
об'єктів ускладнюється їх недостатньою вивченістю. Тому на даному етапі
можливий достатньо спрощений і наближений математичний опис біологіч-них
об'єктів, який потребує істотного удосконалення.
Оптимізація біотехнологічних процесів
здійснюється на основі поєднан-ня експериментального і математичного
моделювання та застосування сучас-них методів оптимізації (динамічного і
нелінійного програмування, варіацій-ного числення). Проте в даний час, для
оцінки оптимальних біотехнологіч-них процесів важко підібрати критерії. При оптимізації в біотехнології
необхідно враховувати обмеження, пов'язані з економічними і конструктив-ними
умовами, можливостями контрольно-вимірювальної аппаратури і за-собів
управління, екологічними вимогами і ін. Моделювання і оптимізація
біотехнологічних процесів – завдання складне і багато в чому ще не виріше-не.
Проте саме розробка адекватних моделей
різних біотехнологічних про-цесів і на їх основі створення досконалих методів
оптимізації і управління – найважливіший напрямок сучасної біотехнології, без
якого неможливий її подальший прогрес.
Підготовка
і стерилізація технологічного повітря потрібна для забезпе-чення дахання
мікроорганізмів - біооб'єктів, більшість з яких
аероби. Використовувати кисень для
аерації можна, проте економічно не
вигідно і небезпечно з точки зору техніки безпеки. Тому використовується
повітря, яке під тиском поступає у ферментатор безпосередньо з атмосфери. Для очищення і стерилізації,
його багато разів фільтрують від пилу фільтрами попереднього очищення, подаючи
компресором із системою охолоджувачів на фільтр грубої очистки з послідуючою
системою стерилізації (головний фільтр, фільтри тонкого очищення). Тобто,
повітря піддається не менше ніж триразовій фільтрації і, як мінімум, двічі
пропускається через стерилізуючі фільтри. При цьому, якщо головний фільтр є
загальним для всіх апаратів в цеху або поза цехом ферментації, то кожен з
фільтрів тонкого очищення відноситься до конкретного апарату. На стадії грубого очищення
(головний фільтр) використовуються волокнисті матеріали, що фільтрують, з
волокнами діаметром від 15 до 50 мкм із скла і базальту з грубозернистими
пористими перегородками. Ефективність очищення на цій стадії досягає 98%. На стадії тонкого очищення
(індивідуальні фільтри) застосовуються тонковолокнисті матеріали (картон і
папір) з волокнами діаметром 0,5 мкм та зернистими жорсткими перегородками
(керамічні і металокерамічні, різні полімери), використовуються також мембранні
фільтри.
При виборі матеріалів, що фільтрують,
враховують розмір бактеріальної клітини (наприклад, для кокових форм діаметр
волокна 1 мкм, а для бактерії кишкова паличка - 2 мкм). Постійне використання
фільтрів, що стерилізують технологічне повітря, вимагає періодичної їх
стерилізації, оскільки затримані фільтром мікроорганізми можуть за сприятливих
умов розмножуватися. Стерилізацію фільтрів проводять обробкою антисептиками,
іонізуючим опромінюванням, або гарячим
паром. Останній метод найбільш надійний і економічний. При виборі режиму
стерилізації обов'язковим є знищення мікробних клітин і спор та збереження
властивостей фільтрувального матеріалу з метою продовження терміну їх служби.
Температура при обробці парою 120 - 125°С тривалістю обробки 20 - 30 хвилин.
Герметизація
і стерилізація устаткування необхідна умова любого технологічного процесу.
Стерильність повинна зберігатись протягом всього робочого циклу, а
технологічний процес повинен бути захищений від контамінації за рахунок
забезпечення герметичності всіх з'єднань в апаратурі. У системах, що працюють в
асептичних умовах, повинна бути забезпечена можливість стерилізації всіх точок
внутрішніх об'єктів апаратів і комуні-кацій. Для цього перед запуском
ферментатора, через нього пропускають насичену водяну пару під тиском.
Промислові ферментатори великого об'єму стерилізують протягом години при 125-
130°С.
Стерилізацію живильних середовищ,
які використовуються
в промисловості (як правило, рідкі, комплексні, рідше синтетичні) проводять
тепловим методом (насиченою парою).
Стійкість
мікроорганізмів до теплової дії визначається багатьма чинниками, зокрема
видовою приналежністю мікроорганізму. Враховується, що спори набагато стійкіші
до нагрівання ніж клітини. На ефективність теплової стерилізації впливає
кількість клітин в середовищі: чим їх менше, тим легше досягається
стерилізуючий ефект. Визначальне значення при тепловій стерилізації мають
температура і тривалість: чим вища температура, тим швидше досягається
стерилізуючий ефект. Теплова стерилізація виконується двома способами:
періодичним і безперервним. При періодичному способі стерилізація відбувається
в самому ферментаторі. Одночасно нагрівається весь об'єм рідини (середовища) до
температури стерилізації, яка витримується певний час, після чого знижує-ться
до заданої. Цей спосіб простий і застосовується у разі невеликих апаратів. Його
недолік: значний градієнт температури за об'ємом і «недосте-рилізація». При
безперервному способі (прогресивнішому і продуктивні-шому) стерилізація
здійснюється в спеціальних установках де температуру можна збільшити до 130 -
150°С, при зменшенні тривалості
стерилізації до 3 - 10 хвилин.
Підготовка
посівного матеріалу багатоступінчата і складається з декіль-кох послідовних
етапів. Спочатку вихідна культура вирощується на агаризованому середовищі в
пробірці. На цьому етапі при її посіві можна контролювати морфологію із
визначенням її чистоти. Далі вирощування проводиться в колбах на рідкому
середовищі з аерацією та перемішуванням початкової культури із рідким живильним
середовищем при певній температурі. Потім початкову культуру, перемішану з
рідким живильним середовищем, переливають в посівний апарат (10 - 25% об'єму інокулятора), де
відбувається подальше перемішування і аерація. При підготовці посівного
матеріалу відбувається поступове збільшення біомаси. У посівному апараті
живильне середовище стабільне, а у ферментаторі в міру накопичення цільо-вого
продукту концентрація вуглецю і азоту зменшується, тобто з часом склад
живильного середовища змінюється.
Процес
біосинтезу найчастіше диференціюється за принципом організа-ції
матеріальних потоків на періодичний, напівперіодичний (або регульова-ний),
безперервний, обємно-доливной, багатоциклічний.
По характеру культивування продуцента
процес біосинтезу поділяється на поверхневу і глибинну ферментації.
За типом цільового продукту в біосинтезі
виділяють біомасу, високомо-лекулярну індивідуальну речовину (ферменти і тому
подібне), низькомолеку-лярні первинний і вторинний метаболіти.
Періодичний процес достатньо простий і
досить часто використовується, проте не завжди є оптимальним. При періодичному
процесі одноразово завантажують у ферментер всі компоненти живильного
середовища і посівний матеріал. Після цього включаються всі елементи
обв'язування ферментера і проводять повний цикл ферментації. Після його
завершення культуральна рідина (разом з міцелієм) зливається і спрямовється в
цех хімічного очищення для виділення цільового продукту. Таким чином, корекції умов біосинтезу під час циклу
ферментації не виконується: немає ні постійної підтримки оптимального
співвідношення вмісу вуглецю, азоту, фосфору, ні додавання в потрібний момент
цільового продукту, ні збережен-ня оптимального значення рН, що позначається на
продуктивності і зниженні цільового продукту ферментації.
Напівперіодичний (регульований) процес в
порівнянні з періодичним прогресивніший: поліпшуються ріст продуцента і
біосинтез цільового продукту, з'являється можливість корекції процесу при його
відхиленнях від оптимальних умов.
Безперервний процес ферментації полягає
в тому, що з ферментатора безперервно відбирають невеликі порції культуральної
рідини і одночасно в нього ж вносять такий же об'єм живильного середовища.
Система виявляється проточною. Використання безперервного процесу доцільне в
тому випадку, якщо цільовим продуктом є безпосередньо сама біомаса вирощуваного
мікроорганізму.
Обємно-доливний процес ферментації є
проміжним між періодичним і безперервним. Культуральна рідина відбирається
крупнішими порціями, ніж в безперервному процесі.
Багатоциклічний процес є ще одним
варіантом періодичної ферментації. Після закінчення ферментації, при зливі
культуральної рідини в апараті залишають її приблизно 10%, потім до
ферментатора вносять 90% (об’єму) свіжого живильного середовища розпочинаючи
новий цикл ферментації.
Таким чином відпадає потреба у
вирощуванні нового посівного матеріалу,
підготовки і стерилізації ферментатора і трубопроводів, економляться час
і засоби.
По характеру культивування продуцента в
живильному середовищі виді-ляють поверхневу і глибинну ферментацію. При
поверхневій ферментації біооб'єкт росте тільки на поверхні рідкого живильного
середовища. Хоча цільовий продукт (якщо він водорозчинний) розподіляється за
всім обсягом середовища, біомаса його продуцента розташовується лише у вигляді
поверхневої плівки в будь-якого роду ємкостях: колбах, бутлях і у фермен-таторі
за умови, що не працюють мішалка і барботажний пристрій, тобто немає ні
масообміну, ні аерації. Біомаси виявляється дуже мало і, відповідно, мало
цільового продукту.
При глибинній ферментації, не дивлячись
на відмінності конструкцій ферментаторів, клітини продуцента внаслідок
перемішування і пропускання під тиском повітря через всю товщу середовища
«працюють» у всьому об'ємі живильного середовища. Це робить процес
високоекономічним. У ферменте-рі створюються умови для накопичення значної
кількості активно функціо-нуючої біомаси продуцента і, відповідно, цільового
продукту.
Процеси ферментації можуть бути
диференційовані в технологічному відношенні і за типом цільового продукту.
Цільовим продуктом може бути біомаса; індивідуальна високомолекулярна речовина
(як правило, це фермент - конститутивний або індуцибельний); низькомолекулярний
метаболіт, який може бути первинним або
вторинним. Таким чином, необхідність в індукторах і попередниках, а також час
їх внесення в середовище залежать від кінцевого продукту. Оскільки біосинтез
вторинних метаболітів характер-ний для певних стадій росту культури продуцента
і стимулюється в так званих стресових ситуаціях, наприклад, при збідненні
середовища джерелами вуглецю, азоту, фосфору, внесення індукторів і попередників
обов'язково у тому випадку, коли метою процесу ферментації є саме вторинний
метаболіт.
При виділенні і очищенні цільового
продукту істотні відмінності між біотехнологічним і хіміко-технологічним
виробництвами виявляються лише на початковому етапі роботи, що обумовлено
специфічною особливістю біотехнологічного процесу - необхідністю розділення
цільового продукту і біомаси (робочий
термін «міцелій»). Якщо
цільовий продукт розчиняється у воді, то при зливі він присутній в
культуральній рідині. Міцелій може бути відокремлений фільтрацією з
використанням різних прийомів (у фільтр-прессах і так далі), сепарацією. При накопиченні цільового
продукту в міцелії тверда і рідка фаза розділяються, після чого цільовий
продукт екстра-гується з міцелію. Для кращого відділення міцелію з
культуральної рідини (за наявності в ній цільового продукту) іноді удаються до
його попередньої коагуляції.
Контрольні
запитання:
1.
Що входить в поняття попередньої підготовки процесу ферментації? 2.
Що таке основний процес і які параметри біосинтезу відносяться до
регульованих? 3. Що таке «обв'язування ферментера» і яке її
значення? 4.
Як можна забезпечити активний масообмін у ферментері, зважаючи на специфіку
культивованих біооб'єктів? 5. У чому різниця між глибинною і поверхневою
ферментацією? Які біооб'єкти використовуються у кожному конкретному випадку? 6.
Які чинники (фізичні, хімічні і біологічні) впливають на процес
ферментації? 7. Розкажіть про процес вирощування посівного
матеріалу. З яких стадій він складається? 8. Як забезпечується стерильність всього
біотехнологічного виробництва? 9.
По яких критеріях можна охарактеризувати процес біосинтезу? 10. Що таке паспорт культури?
http://www.lan.krasu.ru/stadies/editions.asp