Лекция15.
БІОТЕХНОЛОГІЯ
ОТРИМАННЯ
МЕТАБОЛІТІВ
План:
15.1. Біотехнологія синтезу первинних
метаболітів
15.1.1. Виробництво
амінокислот
15.1.1.1. Мікробіологічні методи виробництва амінокислот
15.1.1.2. Хіміко-ферментативні способи отримання амінокислот
15.1.2. Виробництво вітамінів
15.1.3. Виробництво органічних кислот
15.2. Біотехнологія синтезу вторинних метаболітів
15.2.1. Отримання антибіотиків.
15.2.2. Отримання промислово важливих
стероїдів.
15.1. Біотехнологія синтезу первинних
метаболітів
Серед сполук,
що отримуються біотехнологічними методами, амінокис-лоти
займають перше місце за об'ємом виробництва і друге місце за вартістю,
поступаючись по вартості лише антибіотикам. Об'єм світового виробництва
амінокислот становить більше 500 тис. т в рік, з яких 300 тис. т припадає на
глутамат натрію, 100 тис. т на лізин і 140 тис. т на метіонін. За даними ВІЗ,
потреба людства всього лише в чотирьох незамінних амінокислотах становить, млн
т: лізину - 5, метіоніну - 4, треоніна - 3,7 і
триптофану - 2.
Амінокислоти - структурні одиниці
білків. Природні амінокислоти залучені в біосинтез ферментів, ряду гормонів,
вітамінів, антибіотиків, алкалоїдів, токсинів і інших азотовмісних з'єднань (пурини, піримідини...). У
організмі тварини практично половина білкових амінокислот не синтезу-ється. Їх називають незамінними амінокислотами і
повинні надходити в організм з їжею. Нестача кожної з цих амінокислот в харчовому
або кормовому раціоні призводить до порушення обміну речовин, уповільнення
росту і розвитку (табл. 15.1.1.1).
Таблиця 15.1.1.1. Потреба людини в незамінних амінокислотах
|
Амінокислоти |
Потреба, мг/кг маси тіла на добу: |
|
|
діти |
дорослі |
|
|
Валін |
92 |
14 |
|
Гістидин |
33 |
10 |
|
Ізолейцин |
83 |
12 |
|
Лізин |
135 |
16 |
|
Метіонін (і цистеїн) |
99 |
12 |
|
Фенілаланін (і тирозин) |
49 |
10 |
|
Треонін |
68 |
8 |
|
Триптофан |
21 |
3 |
Біотехнологія
мікроорганізмів спрямована на виробництво амінокислот, зокрема незамінимих, які
можуть бути корисними добавками тварин та людини. Серед незамінимих
амінокислот, промислове виробництво налагод-жено лізину, треоніну,
глутамінової кислоти. Отримані штами мікроорга-нізмів
Brevibaeferium flavum, які перетворюють лізин більше однієї третьої цукрів, які
містяться в культурованій рідині. В інституті гентики та селекції промислових мікроорганізмів з допомогою
генно - інженерних методів сконструйовані високопродуктивні штами E. coli, продуценти L - треоніну, L - лізину, L - триптофану, які активно використовуються у промисловості.
Інтерес до мікробіологічного виробництва
амінокислот викликаний і тим, що вони дозволяють отримувати L - амінокислоти
в чистому виді, тоді як при хімічному синтезі рацимічні
суміші L, D, амінокисслот. Останні не входять у
склад природніх білків (лише в пептидах клітинних стінок мікроорганазмів, зокрема пептидах, які є антибіотиками).
Харчова цінність білку визначається
порівнянням частки незамінних амінокислот в їжі з цим же показником при адекватном живленні. Чим ближче
обидві величини, тим вище якість білку. Білки яйця і молока володіють високою
харчовою цінністю і використовуються як еталон при оцінці інших білків. Багато
білків рослинного походження характеризуються дефіцитом окремих незамінних
амінокислот. Білки пшениці і рису мають низький вміст лізину і треоніну, а білки кукурудзи - лізину і триптофану.
Введення синтетичних незамінних амінокислот в кормові концентрати дозволяє збалансувати раціон сільськогосподарських тварин по вмісту білку. При
введенні 2 - 4 дефіцитних амінокислот до 1 т комбікорму загальна витрата кормів зменшується на 15 - 20%, а
вихід продукції збільшується на 20% (табл.15.1.1.2).
Таблиця 15.1.1.2. Потреба сільськогосподарських тварин в незамінних амінокислотах (% до сирого протеїну)
|
Амінокислота |
Свиноматки |
Кури-несучки |
Корови |
|
Лізін |
5,0 |
5,0 |
4,5 |
|
Метіонін |
3,2 |
3,6 |
1,7 |
|
Триптофан |
1,2 |
1,2 |
- |
|
Треонін |
6,0 |
4,0 |
3,4 |
Крім застосування як харчові добавки, приправи і
підсилювачі смаку амінокислоти використовують як сировину в хімічній, парфюмерній і фармацевтичній промисловості і при
виробництві ряду інших речовин: гліцин (підсолоджувач,
антиоксидант, бактериостатик); аспарагінова кислота (під-силювач смаку, сировина для синтезу аспартама); глутамінова кислота (підсилювач
смаку, препарат для лікування психічних захворювань); гісти-дин (протизапальний засіб); метіонін (харчова і кормова добавки); цистеїн (фармацевтичний препарат); треонін і триптофан (харчові і кормові добав-ки); фенілаланін (сировина для отримання аспартама); лізин (харчова і кормова добавки,
сировина для отримання штучних волокон і плівок).
У промислових масштабах білкові
амінокислоти отримують: гідролізом природної
білокодвмісної сировини; хімічним синтезом; мікробіологічним синтезом; біотрансформацією попередників амінокислот за допомогою мік-роорганізмів,
або виділених з них ферментів (хіміко-мікробіологічний метод).
При гідролізі сировину багату білками
(відходи харчової і молочної промис-ловості)
нагрівають з розчинами кислот або лугів при температурі 100 - 105°С протягом 20
- 48 годин. Найчастіше використовують 20% розчин соляної кислоти, що забезпечує
глибокий гідроліз білку. Крім того, для прискорення реакції гідролізу білків
використовують іммобілізовані протеолітичні ферменти і іонообмінні смоли. У
ході кислотного гідролізу білків відбуваються рацемізація і руйнування окремих
складових їх амінокислот. При кислотному гідролізі повністю руйнується
триптофан, частково (10-30%) цистеїн, метіонін і тирозин. Зменшити втрати
амінокислот при гідролізі можливо проведенням його у вакуумі або в інертному
газі та при високому співвідношенні кислоти, узятої для гідролізу, і маси білку
(200:1). Раціональне використання сировини при гідролізі, характерне для
багатьох біотехнологічних виробництв, забезпечуючи створення безвідходних
технологій та оздоровлення навколишнього природного середовища. Раніше методом
гідролізу отримували амінокислоти виключно для фармацевтичних і наукових цілей.
В даний час сфера використання білкових гідролізатів істотно розширилася. Їх
широко використовують в медицині, тваринництві, харчовій та мікробіологічній
промисловості.
Істотний недолік методів хімічного
синтезу амінокислот полягає в отриманні цільових препаратів у вигляді
рацемічної суміші D -і L-стереоїзомерних форм. Переважна
більшість природних амінокислот відносяться до L-ряду. D-а-амінокислоти виявлені лише у складі глікопротеїнів клітинних стінок бактерій, антибіотиків і
окремих токсинів. Проникність L-амінокислот в клітині в 500 разів перевищує проникність її антиподу.
Стереоспецифічні також транспорт і метаболізм амінокислот. Виключеням
в цьому відношенні є лише метіонін, метаболізм якого нестереовибирний,
завдяки чому цю амінокислоту отримують переважно шляхом хімічного синтезу.
Розділення рацематів інших амінокислот - коштовна і надзвичайно трудомістка
процедура.
Найбільш перспективний і економічно
вигідний мікробіологічний синтез амінокислот. Більше 60% всіх
вироблюваних в даний час промисловістю високоочищених
препаратів білкових амінокислот отримують саме цим спо-собом,
головна перевага якого порівняно з методами хімічного синтезу поля-гає в
можливості отримання L-амінокислот на основі поновлюваної сировини.
Останнімі
роками при виробництві амінокислот все ширше використо-вують
біотрансформацію попередників амінокислот, особливо
за допомогою іммобілізованих ферментів або клітин мікроорганізмів, що заздалегідь
отримують хімічним шляхом.
Промислове виробництво амінокислот стало
можливим після відкриття здатності у деяких мікроорганізмів виділяти в культуральне середовище значні кількості однієї з
амінокислот. При цьому встановлено, що більшість з декількох тисяч
проаналізованих диких штамів мікроорганізмів продукували амінокислоти в
зовнішнє середовище, але в дуже незначних кількостях. Не зафіксовано ніякого
зв'язку між таксономічним положенням мікроорганізму і здатністю його до
продукування тієї або іншої амінокислоти. Так, серед можливих продуцентів
глутамінової кислоти відмічені організми, з яких 30% - дріжджі, 30% - стрептоміцети, 20% - бактерії і 10% - мікроскопічні гриби.
І лише один з обстежених штамів мікроорганізмів – Согуnеbасtеrіum glutamicum здатний до надсинтезу глутамата. Даний штам використовували при організації
промислового виробництва глутамінової кислоти мікробіологічним методом в Токіо
(1956). У Росії дослідження в області промислового синтезу амінокислот
розпочаті в 50-х роках минулого століття.
Перспектівні штами продуцентів постійно покращують за допомогою селекції мутантів із зміненою генетичною програмою і регуляторними властивостями. Поширені об'єкти селекції продуцентів - мікроорганізми, що
відносяться до родів Вrevibacterium, Micrococcus, Соrупеbасtеriит, Аrthrobacter (табл. 15.1.1.3).
Таблиця 15.1.1.3. Мікроорганізми - продуценти амінокислот
(по Н. Б. Градової і О. А.
Решітник, 1987)
|
Амінокислота |
Мікроорганізми |
|
Аргінін |
Е. соli, Ваcillus subtilis, Соrynebacterium glutamicum, |
|
|
Вrevibacterium flavum, Serratia marcescens |
|
Гістідін |
В. flavum, С. glutamicum, S. marcescens, види Steptomyces |
|
Ізолейцин |
В. flavum, C. glutamicum, B. Subtilis,
S.
marcescens |
|
Лейцин |
Вrevibacterium lactofermentum, S. marcescens, С. glutamicum |
|
Лізін |
В. flavum, С. glutamicum |
|
Фенілаланін |
В. flavum, C. glutamicum |
|
Пролін |
В. flavum |
|
Серин Треонін Триптофан Тирозин Валін |
С. glutamicum В. flavum, С. glutamicum, Е. соli, S. marcescens Micrococcus, Candida utils, B. subtilis В. flavum, С. glutamicum В. flavum, С. glutamicum |
|
|
|
Розробка технологічної схеми отримання
окремої амінокислоти базується на знанні
шляхів і механізмів регуляції біосинтезу певної амінокислоти. Необхідного
дисбалансу метаболізму, що забезпечує надсинтез
цільового продукту, добиваються шляхом суворо контрольованих змін складу і умов
середовища.
15.1.1.1. Мікробіологічні методи
виробництва амінокислот
Віробніцтво
лізину. За вмістом лізину найменш збалансовані білки
злакових культур, у яких його дефіцит становить від 20 до 50%. Нестача лізину в кормах компенсується введенням в комбікорми сої. Для задоволення потреб тваринництва в лізині промислове його виробництво налагоджене в Іспанії, Франції, Японії і США.
У клітинах мікроорганізмів лізин
синтезується з аспарагінової кислоти і є кінцевим продуктом розгалуженого
метаболічного шляху біосинтезу, загаль-ного для трьох
амінокислот: лізину, метіоніну і треоніну (рис. 15.1.1.1.1).
Таким чином, в процесі новоутворення
амінокислот одночасно з лізином синтезуються амінокислоти - метіонін і треонін. В цьому випадку синтез в середовищі лише однієї
певної амінокислоти добиваються шляхом блокування процесів, які призводять до
синтезу побічних амінокислот, що виникають у зв'язку з розгалуженням
метаболічного шляху.
Утворення лізину в клітині бактерії
знаходиться під суворим метаболіч-ним контролем. У
типових продуцентів L-лізину - Вrevibacterium flavum, і Соrynebacterium glutamicum - фермент аспартаткіназа, що вилучає метаболіч-ний шлях, є аллостеричним
білком, чутливим до інгібірування за принципом
зворотного зв'язку при сумісній і узгодженій дії побічних продуктів L-треоніну і L-лізину. При накопиченні треоніну і
лізину в надмірній концентрації інгібірується аспартаткіназа і їх синтез зупиняється, при зниженій
концентрації однієї з двох амінокислот процес активізується.
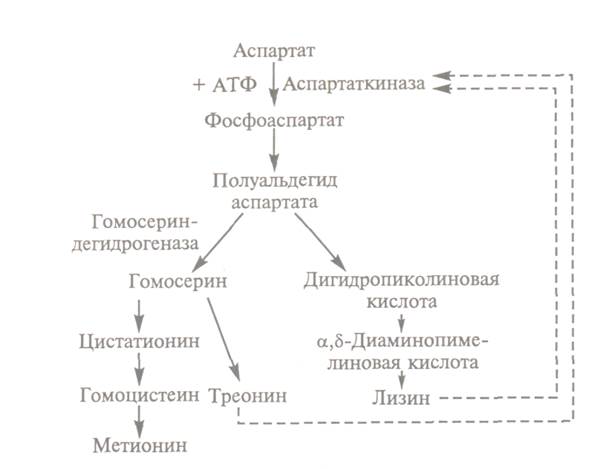
Рисунок.
15.1.1.1.1. Схема біосинтезу лізину, метіоніну
і треонина в клітинах Соrynebacterium glutamicum Вrevibacterium flavum: ---- інгібірування за принципом зворотного зв'язку
При синтезі лізину у значних об’ємах, спочатку отримують мутанти двох
типів. У мутантів першого типу не синтезується або не функціонує гомосериндегідрогеназа, внаслідок чого блокується синтез
метіоніну і треоніну. Такі мутанти є ауксотрофами по гомосерину або треоніну
(метіоніну); внутріклітинна концентрація треоніну у
них істотно понижена, що знімає блокаду із аспартаткінази.
Тому при вирощуванні штамів мутантів в середовищі, де присутні лімітуючі концентрації метіоніну і треоніну,
вони здатні утворювати надмірну кількість лізину. Мутанти другого типу дефектні
по структурному гену, що детермінує конформацію аспартаткінази. В результаті
фермент втрачає чутливість до високих концентрацій аллостеричного інгібітору - лізину.
Важливим фактором, який забезпечує в культуральному середовищі високі концентрації амінокислоти,
синтезованої клітиною - проникність клітинних мембран. Її збільшують або за
допомогою мутацій, або шляхом зміни складу живильного середовища. У останньому
випадку в культуральному
середовищі створюють дефіцит біотину (1-5 мкл/л),
додають пеніцилін (2-4 мкг/л), детергенти (твін-40 і
твін-60) або похідні вищих жирних кислот (пальмитати,
стеарати). Біотин контролює вміст в клітинній
мембрані фосфоліпідів, а пеніцилін порушує біосинтез клітинних стінок бактерій,
що підвищує виділення амінокислот в середовище.
Для культивування штамів мікроорганізмів
при виробництві амінокислот, як джерела вуглецю, найбільш доступні вуглеводи -
глюкоза, сахароза і рідше фруктоза та
мальтоза. Для зниження вартості живильного середовища, як джерела
вуглецю, використовують вторинну сировину: бурякову мелясу, молочну сироватку,
гідролізат крохмалю, сульфітний луг. Технологія такого процесу удосконалюється
у напрямку розробки дешевих синтетичних живильних середовищ на основі оцтової
кислоти (до 1,5%), пропіонової кислоти, метанолу,
етанолу (до 1%) і н-парафінів. Як джерела азоту застосовують сечовину і солі амонію (сульфати і
фосфати). Для оптимального розвитку мікроорганізмів в живильне середовище
вводять стимулятори росту (екстракти
кукурудзи, дріжджів і солодових паростків, гідролізат висівок і дріжджів,
вітаміни групи В), необхідні для життєдіяльності макро
-і мікроелементи (Р, Са, Мg, Мn, Fе…). На процес
біосинтезу амінокислот істотний вплив справляє забезпеченість повітрям, ступінь аерації якого індивідуальний для
виробництва певної амінокислоти.
Результати досліджень показали, що
синтез лізину в культуральному середовищі
розпочинається із середини експотенціальної фази
росту культури клітин мікроорганізму і сягає максимуму до її кінця. Тому на
першій стадії технологічного процесу формують біомасу продуцента, яку вирощують
в спеціальних посівних апаратах протягом доби (рН 7,0-7,2;
температура 28-30°С), а потім подають у виробничий ферментер, заповнений
живильним середовищем. Синтезований лізин розпочинає надходити в культуральну рідину через 25-30 годин після початку
ферментації. Після закінчення процесу ферментації (через 55-72 годин) рідку
фазу відокремлюють від культури клітин мікроорганізму фільтруванням і
використовують для виділення з неї лізину.
Високоочищені
препарати лізину отримують після фракціонування фільтрату культуральної
рідини методом іонообмінної хроматографії на катіоніті.
З цією метою лізин переводять у форму катіона:
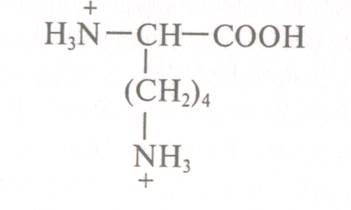
Для даного процесу фільтрат обробляють
соляною кислотою до рН 1,6 - 2,0 (рН<рК1). Володіючи двома позитивно зарядженими іоногенними
угрупуваннями, лізин міцно сорбується на смолі і елююється з неї у вигляді індивідуального з'єднання
0,5-5%-м розчином гідроксиду амонію після виходу всіх інших катіонів. Елюат концентрують у вакуумі при температурі 60°С, переводять
у форму монохлоргідрату, після чого висушують і
додатково очищають за допомогою перекристалізації. В результаті отриму-ють препарати кристалічного лізину 97-98% чистоти,
яка використовується для підвищення поживної цінності харчових продуктів і в
медичній промисловості (рис. 15.1.1.1.2).
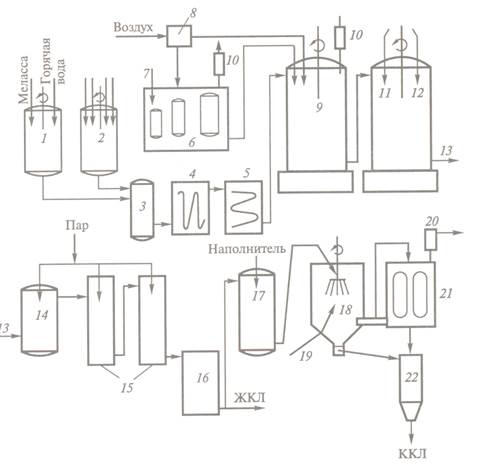
Рисунок 15.1.1.1.2.
Технологічна схема отримання кормових препаратів лізин (по В.С.Шевелухе і
ін., 1998). де: 1 - подача бурякової меляси; 2
- водна суспензія кукуру-дзяного екстракту і
живильних солей; 3 - нагрівальна колонка; 4, 5 – теплообмінни-ки; 6 - посівні апарати; 7 - подача
посівного матеріалу; 8 - система фільтрів для очи-щення
і стерилізації повітря; 9 - ферментер; 10 - фільтри для очищення
газів, що відходять; 11 - отримання монохлоридгідрата
лізину; 12 - подача соляної кислоти; 13, 14 - вихід і підігрів монохлоридгідрату лізину; 15 - випарувательна
установка; 16 - збірка
рідкий концентрат лізину (ЖКЛ); 17 - змішування ЖКЛ з наповнювачем; 18
- розпилювач; 19 - подача гарячого повітря; 20 - очищувач
повітря; 21 - відділення сухого препарату лізину від повітря; 22 -
приймач кормовий концентрат лізину (ККЛ).
Окрім високоочищених
препаратів лізину отримують і інші види його товарної форми: рідкий концентрат
лізину (ЖКЛ), сухий кормовий концент-рат лізину (ККЛ)
і висококонцентровані кормові препарати, що характеризу-ються
щодо меншим ступенем очищення порівняно з першим препаратом.
Іншою по значимості незамінною
амінокислотою для харчування людини і тварин є метіонін, який отримують
переважно шляхом хімічного синтезу, що економічно вигідніше порівняно з
мікробіологічним способом.
Виробництво триптофану. Він достатньо
часто є лімітуючим фактором живлення, оскільки його
вміст в традиційних продуктах (риба, молоко, кормові дріжджі) в 3 рази нижче,
ніж в стандартному білку.
Аналогічно лізину, триптофан
синтезується в ході розгалуженого мета-болічного
шляху, тому для його виробництва використовують ауксотрофних мутантів, в яких блоковані реакції, що ведуть до синтезу фенілаланіну і тиро-зину. Проте при вирощуванні
штамів мутантів в середовищі з мінімальною концентрацією цих амінокислот, що не
викликає регуляторних ефектів, надмірне накопичення триптофану не
спостерігається, що пояснюється особливістю процесів регуляції біосинтезу
триптофану у мікроорганізмів.
Разом з іншими ароматичними
амінокислотами у мікроорганізмів (анало-гічно
більшості організмів) триптофан утворюється з метаболітів вуглевод-ного обміну
- еритрозо-4-фосфату і фосфоенолпірувату.
Процес новоутворення ароматичних
амінокислот відбувається через шикимову і хоризмову кислоти. Метаболічним попередником триптофану є антранілова кислота, яка виникає з хоризмової
кислоти під дією антранілат-синтетази. Триптофан інгібуюче впливає на антранілатсинтетазу,
тому для уникнення метаболічного контролю синтез ферменту індукують ступінчас-тим введенням попередника - антранілової
кислоти (0,1-0,3%):
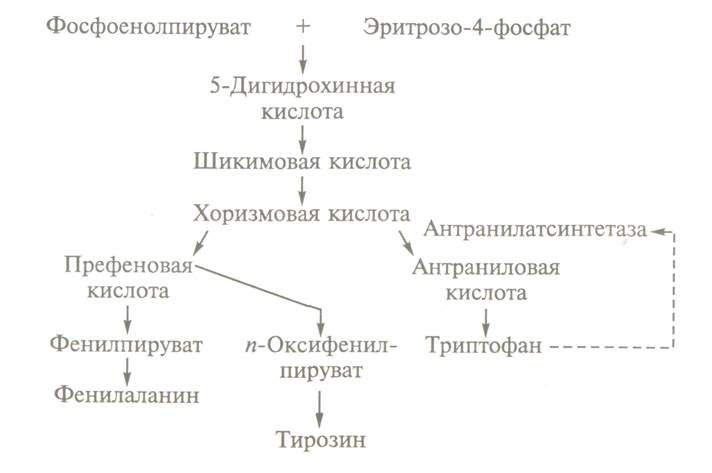
У зв'язку з цією особливістю промислове
виробництво триптофану організоване переважно по двоступінчатій
схемі. На першому етапі хімічним способом синтезують антраніловую
кислоту, яку за допомогою ензиматичної системи штамів мутантів дріжджів Сапdida utilis переводять в триптофан.
Біомасу дріжджів продукують при температурі 30°С у середовищі, що містить бурякову мелясу,
сечовину і мінеральні компоненти. Через добу у ферментер вводять 5%-й спиртовий
розчин антранілової кислоти і 50%-й розчин сечовини,
а через 3-4 години після їх введення додатково додають джерело вуглецю (25 %-й
розчин меляси). Антранілову кислоту і сечовину
подають через кожних 6, а мелясу - через кожних 12 годин. Процес двоступінчатої ферментації завершується через 144 годин,
забезпечуючи вміст триптофану в культуральному
середовищі до 6 г/л.
Окрім триптофану мікробіологічним
способом з використанням попередників отримують гістидин,
ізолейцин, метіонін, серії і треонін.
Менш поширені одноступінчаті
технології отримання триптофану на основі ауксотрофних
мутантів бактерії Васillus subtilis, по схемі близькій до
способу отримання лізину. Тривалість одноступінчатого
процесу 48 годин, а концентрація триптофану в культуральному
середовищі становить 10 г/л.
Після висушування культуральної
рідини отримують кормовий концентрат триптофану (ККТ), який включає білки,
вільний триптофан, вітаміни В1, В2 і РР. Високоочищені кристалічні препарати триптофану утворюються
після додаткового очищення культуральної рідини
методом іонообмінної хроматографії на колонці, заповненій катіонітом
(сорбція при рН 1,0; елюція
5%-м розчином гідроксиду амонію в суміші з пропанолом-2). Елюати
кристалізують, а кристали відмивають і висушують. Кристалічний препарат містить
до 99% триптофану.
Характерна особливість процесів
отримання амінокислот мікробіологіч-ним способом, так
само як і інших біотехнологічних виробництв - повне використання побічних
продуктів, що перетворює більшість з них в безвідходні і екологічно чисті
технології. Наприклад, осад мікроорганізмів-продуцентів і промивні води, що
містять цінні інгредієнти (білки, залишки амінокислот, вітамінів, мінеральних
солей і мікроелементів), висушують і використовують як кормові препарати.
Отримання аргініну, глутамінової
кислоти, глутаміну, треоніну і проліну
мікробіологічним способом. Для отримання амінокислот -
кінцевих продуктів нерозгалужених метаболічних шляхів, наприклад аргініну, застосовують
мутанти з дефектами регуляції біосинтезу
амінокислоти, тобто регуляторні мутанти. Крім аргініну регуляторні мутанти
використовують для отримання серину і цитруліну:
Глутамат -- N-Ацетил -- М-ацетилглутаміл – Напівальдегід --
глутамат фосфат N-Ацетилглутамату
— N-ацетил — Орнітин —
Цитрулін -- Аргиніно— Аргінін --
орнітин сукцинат
Виробництво за участю мікроорганізмів
глутамінової амінокислоти, глу-таміну і проліну,
забезпечує стимуляція утворення амінокислот у відповідь на зміну умов зовнішнього
середовища. Метаболічним попередником при біосинтезі глутамінової кислоти
служить а-кетоглутарова
кислота, що синтезується в циклі Кребса з ізолимонною
кислотою під дією ізоцитратдегідрогенази. При
вирощуванні бактерій родів Соrупеbасtеrіuт або Вrеvibacterium на вуглецевій сировині (гідролізат
крохмалю, очеретяна або бурякова меляса), на етанолі або ацетаті і при дефіциті
біотину в культуральному середовищі накопичується
глутамінова кислота з концентрацією 30 г/л. Найважливіша умова для її утворення
- придушення активності глутаматдегідрогенази. При високому вмісті в середовищі
біотину і солей амонію забезпечуються умови для утворення проліну, а при
значних концентраціях іонів амонію і іонів цинку в слабокислому
середовищі - для синтезу глутаміну.
Генетична інженерія - найважливіший
прогресивний спосіб зміни генетичної програми організму в цілях створення
високопродуктивних штамів промислових мікроорганізмів. Успіхи сучасної
генетичної інженерії істотно впливають на промислову біотехнологію. Яскравий
приклад можливостей генетичної інженерії
- створення у науково-дослідному інституті генетики і селекції промислових
мікроорганізмів штаму Е. соli для отримання треоніну.
В результаті були змінені не
лише регуляторні властивості ферменту аспартаткінази, але і живильні потреби штаму. Введення в
геном бактерії нового гена забезпечило бактерії можливість використання як
джерела вуглецю сахарозу, основного дисахариду традиційної промислової сировини - бурякової
меляси. Перераховані маніпуляції разом з ампліфікацією плазмід, що містять оперон треоніну, дозволили значно
збільшити продуктивність штаму бактерії і отримати за 40 годин ферментації
15.1.1.2. Хіміко-ферментативні
способи отримання амінокислот
При отриманні ряду амінокислот
хіміко-ферментативними способами використовують ензими, що належать до різних
класів. Ці процеси можуть бути як одностадійними (конверсії), так і багатостадійними. Джерелом ферментів для
більшості процесів служать ензими мікроорганізмів - як індивідуальні, так і їх
природні суміші, що містяться в інтактних (що не ростуть), висушених і лізірованих клітинах, клітинних екстрактах і в препаратах
іммобілізованих клітин і ферментів. Застосування ферментів у виробництві
амінокислот забезпечує стереоспецифічність процесів
їх синтезу, що вигідно відрізняє біотехнологічні виробництва від хімічних.
Отримання L-лізну. Процес отримання лізину заснований на стереоспецифічному ферментативному гідролізі (конверсії) D-,L-а-аміно-c-капролактама, який спочатку отримують хімічним шляхом з циклогексену:
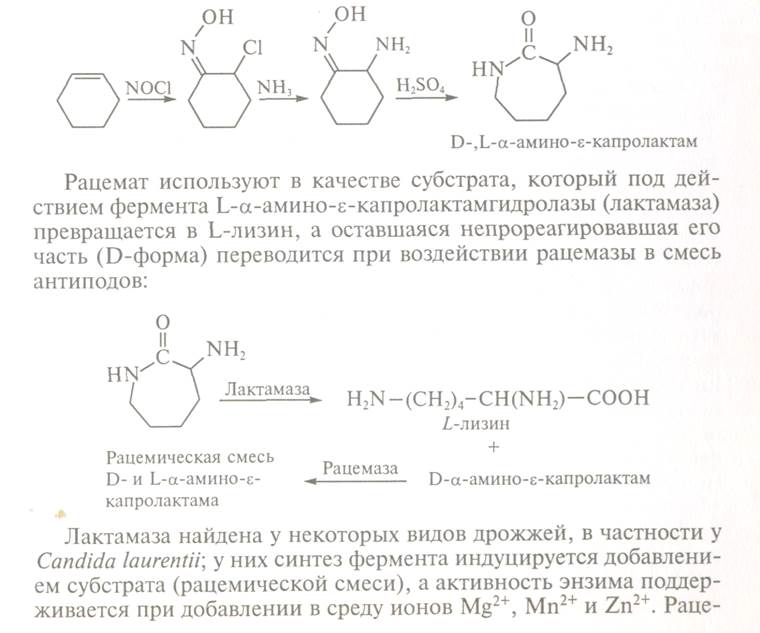
Лактамаза
присутня у деяких видів дріжджів, зокрема у Сапdida laurentii; в яких синтез ферменту індукується додаванням субстрату (рацемічній суміші), а
активність ензиму підтримується при додаванні в живильне середовище іонів Мg2+, Мn2+ і Zn2+. Рацемаза виявлена у ряду бактерій,
наприклад у А1саligenes obae. Для отримання неочищених ферментів
цілі клітини мікроорганізмів обробляють поверхнево-активними речовинами, що
викликають зміну проникності стінки клітин мікроорганізмів-продуцентів.
Розроблені іммобілізовані форми обох ферментів. При виробництві лізину у водний
розчин D-,L-а-аміно-е-капролактаму одночасно
вводять лактамазу і рацемазу, що містяться в
дріжджових і бактеріальних клітинах. Процес проходить при 30-50°С, рН 8,0-8,5 і
оптимальному режимі аерації. На виході з реактора утворюється переважно один
продукт - лізин, який виділяють з суміші, очищають і висушують. Описана
технологія отримання лізину, поширена в США і Японії, після закінчення процесу
забезпечує вміст амінокислоти в реакційному середовищі понад 150 г/л. Крім
того, створені мутанти, у яких цільовий продукт, лізин повторно не залучається
до обміну речовин, що збільшує вихід необхідного продукту.
Отримання триптофану. Хіміко-ферментативний спосіб отримання триптофану полягає в прямій
конденсації індолу, аміаку і піровиноградної кислоти:
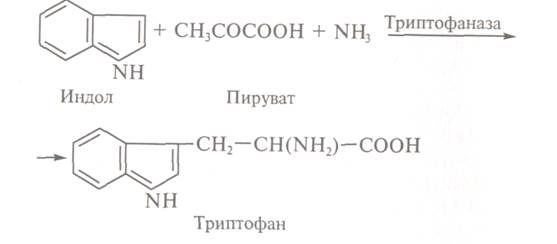
Реакцію каталізує
фермент піридоксальзалежна триптофан-індоліаза (тріптофаназа), який широко поширений в природі.
Тріптофаназа прискорює реакції а, b-ілімініровання і b-заміщення, але її вплив може бути і у бік реакції конденсації. Додавання
триптофану індукує утворення ферменту, а додавання індолу інгібує його синтез у
бактерій, тому процес отримання триптофану проводять при надлишку аміаку і
пірувату.
Вихід амінокислоти при реалізації хіміко-ензиматичного способу отримання триптофану становить 63 г/л.
Набір ензимів, що використовуються для
отримання амінокислот, достатньо різноманітний. До їх числа відносяться гідролази, дегідрогенази, ліази, лігази, ізомерази. Такий же різноманітний і перелік цільових
амінокислот, синтезованих хіміко-ферментативним способом (L-аспарагінова
кислота, L-аланін, L-глутамін, L-лізин, L-тирозин, L-триптофан, L-цистеїн, L-фенін-лаланін, L-метіонін).
Хіміко-ензиматичний спосіб порівняно з мікро-біологічним більш специфічний, не
вимагає процедури очищення аміно-кислот від побічних
продуктів і стічних потоків. Проте за вартістю сировини і ферментативних
препаратів він поступається мікробіологічному способу.
15.1.1.2. Виробництво вітамінів
Вітаміни - це
низькомолекулярні органічні сполуки, роль яких для нор-мальної
життєдіяльності організму добре відома. Оскільки в харчових продуктах вітамінів
міститься небагато (в 100 мл на100 г їжі) і вони швидко руйнуються, виникає
потреба у вітамінізації готової їжі та продуктів. Традиційно способи отримання
вітамінів базуються або на перобці великої кількості сировини,
або на штучному синтезі.Вітаміни є групою незамінних органічних сполук
різної хімічної природи, необхідних будь-якому організму в досить низьких
концентраціях, виконуючи каталітичні і регуляторні функції. Нестача того або
іншого вітаміну порушує обмін речовин і нормаль-ні процеси життєдіяльності
організму, сприяючи патологічним станам. Вітаміни не утворюються у гетеротрофів. Здатністю до синтезу вітамінів володіють лише
автотрофи, зокрема рослини. Багато мікроорганізмів утворюють цілий ряд вітамінів,
тому синтез їх за допомогою мікроорганізмів став основою для розробки
технологій промислового виробництва цих біологічно активних сполук.
З допомогою
генетичних маніпуляцій отримані штами мікроорганізмів, які продукують в десятки
тисяч разів більше вітамінів, ніж необхідно для їх росту. Це штами Denitifrilicans і Propionibaeferium freudenreichii, які продукують вітаміни В12 та інші. На базі Bacillus subtilis сконструйовано ефективний продуцент вітаміну В12.
Мікробіологічна
технологія дозволила вирішити і проблему виробництва аскорбінової кислоти
(вітамін С). В Японії розроблений ефективний фермен-тативний спосіб отримання стабільного необхідного вітаміну С - аскорбін - 2 - фосфата, який використовується в якості антиоксиданту.
Завдяки вивченню фізіології і генетики
мікроорганізмів - продуцентів вітамінів і з'ясуванню шляхів біосинтезу кожного
з них створена теоретична основа для отримання мікробіологічним способом
практично всіх відомих в даний час вітамінів. Проте за допомогою ензимів
доцільно проводити лише особливо складні по будові вітаміни: В2, В12,
b-каротин (провітамін А) і попередники вітаміну D. Решту вітамінів або виділяють з
природних джерел, або синтезують хімічним шляхом, використовуючи як лікувальні
препарати, для створення збалансованих харчових і кормових раціонів і для інтенси-фікації біотехнологічних процесів.
Отримання вітаміну В2
(рибофлавіну). В 30-х роках минулого століття
рибофлавін виділяли з природної сировини. У найбільшій концентрації він
присутній в моркві і печінці тріски. З 1 т моркви можна ізолювати лише
До складу живильного середовища для
росту продуцентів вітаміну В2 входять достатньо складні органічні
речовини - соєве борошно, кукурудзяний екстракт, сахароза, карбонат кальцію,
хлорид натрію, гідрофосфат калію, вітаміни, технічний
жир. Гриби досить чутливі до зміни складу середовища і схильні до інфікування.
Перед введенням у ферментер середовище піддають стерилізації, додаючи
антибіотики і антисептики. Готують рідке живильне середовище і посівний
матеріал культури дріжджів в різних ємкостях -
ферментері і посівному апараті.
Як посівний матеріал використовують
спори Е. ashbyii, вирощені на пшоні (7-8 днів при 29-30°С). Після стерилізації
рідкий посівний матеріал подається у ферментер. Процес ферментації грибів для
отримання кормового рибофлавіну триває 3 діб при температурі 28-30°С.
Концентрація рибофлавіну в культуральній рідині може
сягати 1,4 міліграм/мл. Після закінчення процесу ферментації культуральну рідину концентрують у вакуумі, висушують до
5-10% і змішують з наповнювачами.
У 1983 році в науково-дослідному
інституті генетики мікроорганізмів сконструйований рекомбінантний
штам продуцента Ваcillus subtilis, що характеризується підвищеною дозою оперонів, які
контролюють синтез рибофлавіну. Клонуванням генів рибофлавинового
оперона в одній із створених плазмід був отриманий
виробничий штам-продуцент вітаміну В2, здатний синтезувати втричі
більше порівнянню p Е. ashbyii, кількість
рибофлавіну всього за 40 годин ферментації.
Отримання вітаміну В12 (Соа[а-(5,6-диметилбензимидазолил)]-Сор - ціанокобамід). Вітамін В12 синтезований
у 1948 році одночасно в США і Англії. У 1972 році в Гарвардському університеті
був проведений хімічний синтез корриноїдного попередника вітаміну В12. Хімічний синтез корнесте-рона - структурного елементу корринового кільця вітаміну, що включає 37 стадій, в крупних масштабах не
відтворений із-за складності процесу.
Вітамін В12 регулює
вуглеводний і ліпідний обмін, бере участь в метаболізмі незамінних амінокислот,
пуринових і піримідинових основ, стимулює утворення
попередників гемоглобіну в кістковому мозку; застосо-вується
в медицині для лікування злоякісної анемії, променевої хвороби, захворювань
печінки, поліневриту… . Введення вітаміну до корм сприяє повноціннішому
засвоєнню рослинних білків і підвищує продуктивність сільськогосподарських
тварин на 10-15 відсотків.
Спочатку вітамін В12
отримували виключно з природної сировини, але з 1 т печінки можна було виділити
всього 15 міліграмів вітаміну. Єдиний спосіб його отримання в даний час -
мікробіологічний синтез. Виявлення вітаміну як побічного продукту при
виробництві антибіотиків в значній мірі стимулювало пошук
організмів-продуцентів вітаміну і вивчення шляхів його утворення. Проте
механізми регуляції біосинтезу вітаміну В12 до теперішнього часу
повністю не розшифровані. Відомо, що при високих концентраціях вітамін повністю
репресує синтез ключових ферментів свого новоутворення.
Продуцентами вітаміну В12 при
його промисловому отриманні служать актиноміцети, метанотворні
і фотосинтезуючі бактерії, одноклітинні водорості.
У 70-х роках XX століття інтерес учених привернули пропіоновокислі
бактерії, відомі з 1906 року, що широко використовуються для приготування
препаратів в тваринництві. Виділено 14 видів пропіоновокислих
бактерій, що продукують вітамін В12. Для отримання ви-сокоочищених препаратів вітаміну В12 пропіоновокислі бактерії культивують періодичним способом
на середовищах, що містять глюкозу, казеїновий гідролізат, вітаміни,
неорганічні солі, хлорид кобальту. Введення в середовище попередника
5,6-диметилбензимідазола (сприяє переводу неактивних форм в природний продукт)
після закінчення першої ростової фази (5 - 6 діб) стимулює швидкий (18 - 24
годин) синтез вітаміну з виходом останнього 5,6 - 8,7 міліграм/л. Шляхом
селекції, оптимізації складу середовища і умов культивування вихід вітаміну В12
в промислових умовах був значно підвищений. На середовищі з кукурудзяним
екстрактом і глюкозою при підтримці стабільного значення рН
в межах нейтральних зон вихід вітаміну сягає 21 - 23 міліграма/л. Мутант пропіоновокислих бактерій продукує до 30 міліграма/л
вітаміну. Застосування ущільнюючих агентів (агар, крохмаль), що запобігають
осіданню бактерій, а також використання високоанаеробних
умов і автоматичної підтримки рН дозволяє отримати
найбільш високий вихід вітаміну - 58 міліграм/л.
З культуральної
рідини вітамін В12 виділяють екстракцією органічними розчинниками,
іонообмінною хроматографією з подальшим осадженням з фракцій у вигляді труднорозчинних сполук. В процесі
отримання вітаміну В12 за допомогою пропіоновокислих
бактерій застосовують дорогу антико-розійну
апаратуру, складні і дорогі живильні середовища. Удосконалення технологічного
процесу відбувається у напрямку здешевлення компонентів живильних середовищ
(заміна глюкози сульфітними лугами) і переходу з періодичного культивування на
безперервний процес. Останніми роками досліджується можливість отримання
вітаміну з використанням іммобілізо-ваних клітин пропіоновокислих бактерій. За вказаною технологією фермен-тацію
здійснює складний біоценоз термофільних мікроорганізмів, які забезпечують метанове бродіння. Комплекс мікроорганізмів
включає целлю-лозорозкладаючі, вуглецевозброджуючі,
амоніфікуючі, сульфітвідновлюючі
і метанотворні бактерії. На першій фазі процесу (10 -
12 днів) розвиваються термофільні вуглецевозброджуючі
і амоніфікуючі бактерії. При цьому в слабокислому середовищі (рН 5,0 - 7,0)
органічні сполуки перетворюються на жирні кислоти і аміак. На другій фазі, коли
середовище підлуговують до рН 8,5, в біоценозі
переважають метанотворні бактерії, які зброджують
продукти, що виникають на першій фазі, до метану і діоксиду вуглецю. Саме метанотворні бактерії - головні продуценти вітаміну.
Збагачення середовищ очищеними культурами метанотворних
бактерій збільшує вихід активних форм вітаміну В12.
Джерелом вуглецю в живильному середовищі
є ацетонобутилова і спиртна барда (побічна продукція цукрових заводів та спиртзаводів). Для оптимізації живильного середовища в неї
вводять сполуки кобальту (хлорид кобальту - 4 г/м3), який входить до
складу молекули вітаміну В12, і субстрати для росту метанотворних бактерій - нижчі жирні кислоти і нижчі
спирти, що дозволяє значно підвищити вихід вітаміну.
Підготовлену сировину звільняють в
декантаторі від зважених частинок і безперервно подають в нижню частину
ферментера (метантенка) ємністю
Процес промислового отримання вітаміну В12
- приклад безвідходної і екологічно чистої технології. Сировиною для їх
виробництва є масові відходи, а кінцевими продуктами - біогаз (65% метану, 30%
діоксиду вуглецю), що використовується як паливо, і біомаса метанових бактерій
- джерело біологічно активних сполук, що активують,
ріст молочнокислих бактерій.
Отримання b-каротину і
вітаміну D2). Важливе місце в обміні речовин у тварин займає b-каротин, який в печінці перетворюється на вітамін А (ретинол). У
організмі людини і тварин каротини не утворюються.
Основні джерела b-каротину для тварин - рослинні корми;
людина отримує b-каротин з продуктів тваринного походження. b-каротин можна виділити з ряду рослинних об'єктів - моркви, гарбуза,
обліпихи, люцерни. На початку 60-х років XX століття розроблена схема
мікробіологічного синтезу b-каротину, яка стала
основою промислового способу його виробництва. Встановлено, що багато
мікроорганізмів (фототрофні бактерії, актиноміцети,
цвілеві гриби, дріжджі), синтезують каротин. Характерно, що вміст b-каротину у
мікроорганізмів перевищує вміст його у рослинах. Так, в
Мікробіологічним способом отримують і
вітамін D2 (ерго-кальціферол),
при виробництві якого освоєна дешева сировина (вуглеводи) і встановлений
стимулюючий ефект ультрафіолетових променів на синтез ергостерину культурою
дріжджів.
Очікується
розширення набору вітамінів, що синтезуються методами біотехнології. Для
вирішення проблеми промислового отримання вітамінів необхідне впровадження
нехарчової малодефіцитної сировини, розробка
спеціальних режимів культивування надпродуцентів,
переведення процесів на безперервні технології, використання перспективних
хіміко-фермен-тативних
способів синтезу вітамінів.
15.1.3. Виробництво органічних
кислот
В даний час
біотехнологічними методами в промислових масштабах синтезують ряд органічних
кислот. З них лимонну, глюконову, кетоглю-коновую
і ітаконову кислоти отримують лише мікробіологічним
способом, молочну, саліцилову і оцетову - як
хімічним, так і мікробіологічним, а яблучну - хімічним і ензиматичним.
Отримання оцтової кислоти. Оцтова кислота найбільш поширена серед інших органічних кислот. Її
використовують при виробництві багатьох хімічних речовин, включаючи каучук, пластмаси, волокна, інсектицидів. Мікробіологічний спосіб
отримання оцтової кислоти полягає в конверсії етанолу в оцтову кислоту при
участі бактерій штамів Асеtobacter і Gluconobacter.
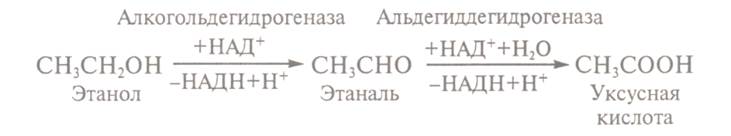
Процес проходить в анаеробних умовах в
режимі безперервного куль-тивування продуцента. Для
росту бактерії Асеtobacter асеti використовують живильні середовища,
що містять 6-12% етилового спирту, 1% бактерійного гідролізату, 0,05% дигідрофосфату калію, 0,1% гідрофосфату
амонію і 0,05% сульфату магнію. Максимальна питома активність безперервної
культури Асеtobacter асеti (кількість мікрограмів субстрату,
що піддався окисленню 1мкг біомаси за 1 хвилину) досягається на 20-у добу культивування при
концентрації спирту 7% і становить 3,0 одиниці/міліграм.
Отримання лимонної кислоти. Лимонну кислоту широко використову-ють в
харчовій, фармацевтичній і косметичній промисловості. Нею замінюють фосфати у
складі детергентів, оскільки вона повністю метаболізу-ється
живими організмами. Лимонна кислота утворює хелати з
металами, тому її застосовують для їх очищення. Об'єм світового виробництва
цитрату складає 400 тис. т/год. Найбільший виробник лимонної кислоти - США.
Виробництво лимонної кислоти належить до старих (1893 рік) промислових
мікробіологічних процесів.
Для промислового виробництва лимонної
кислоти використовують головним чином культуру гриба Аspergillus niger, а також Аspergillus wentii.
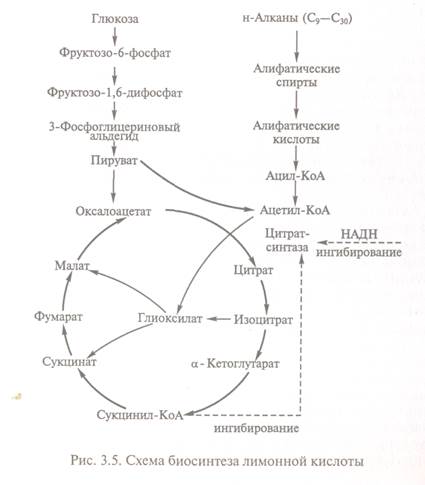
Метаболічним джерелом лимонної кислоти
в організмі служить цикл трикарбонових кислот - складова частина циклу Кребса:
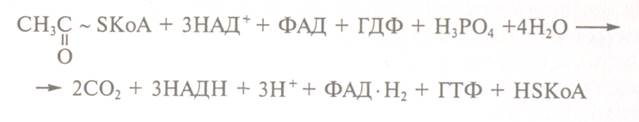
Реакція утворення лимонної кислоти, цитратсинтазою, що каталізує,
відкриває цикл Кребса, в якому цитрат поступово окислюється до щавлево-оцтової кислоти, яка повторно конденсується з
ацетил-КоА, утворюючи повторно лимонну кислоту (рис.15.1.1.1.3).
Цитратсинтаза
визначає швидкість реакцій, складових циклу Кребса. Активність ферменту
залежить від концентрації щавлево-оцтової кислоти,
вміст якої може підтримуватися за рахунок функціонування конститутивної піруваткарбоксилази, що забезпечує переведення в аеробних
умовах процесів гліколізу і гліоксилевого циклу.
Активність цитратсинтази гальмується НАДН і сукциніл-КоА. Швидкість повторення циклу Кребса визначається
підтримкою необхідного рівня окислених форм коферментів дегідрогенази
(Над+ і ФАД, тому високий вихід цитрату отримують лише за умови доброї аерації.
Накопичення в культуральному середовищі істотних
кількостей цитрату - проміжного з'єднання циклу Кребса - невигідно для
організму і є наслідком дисбалансу метаболізму або порушення його генетичної
природи. Ріст культури грибів зазвичай регулюється шляхом зміни вміст фосфату,
іонів марганцю, заліза і цинку в середовищі. Дефіцит фосфату призводить до надпродукції цитрату. Роль іонів металів до кінця не встановлена. Вважають, що дефіцит
іонів металів впливає на властивості клітинних мембран і морфологію гіф.
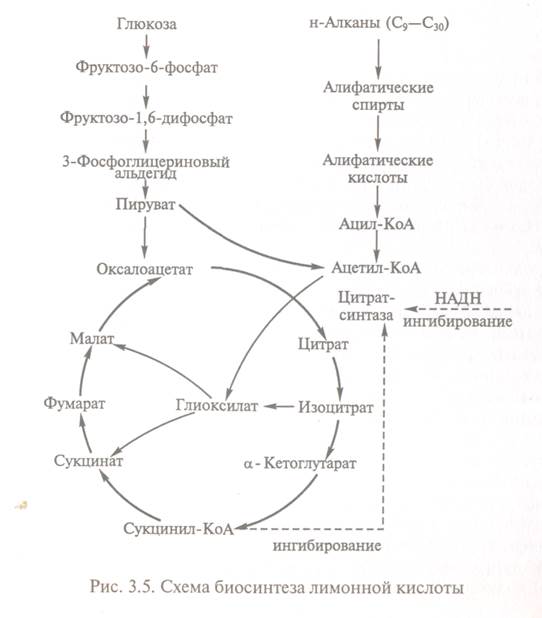
Рисунок 15.1.1.1.3. Схема біосинтезу лимонної кислоти
Цитратсинтаза визначає
швидкість реакцій, складових циклу Кребса. Активність ферменту залежить від
концентрації щавлево-оцтової кислоти, вміст якої може
підтримуватися за рахунок функціонування конститутивної піруваткарбоксилази,
що забезпечує переведення в аеробних умовах процесів гліколізу і гліоксилевого циклу. Активність цитратсинтази
гальмується НАДН і сукциніл-КоА. Швидкість повторення
циклу Кребса визначається підтримкою необхідного рівня окислених форм
коферментів дегідрогенази (Над+ і ФАД, тому високий
вихід цитрату отримують лише за умови доброї аерації. Накопичення в культуральному середовищі істотних кількостей цитрату -
проміжного з'єднання циклу Кребса - невигідно для організму і є наслідком
дисбалансу метаболізму або порушення його генетичної природи. Ріст культури
грибів зазвичай регулюється шляхом зміни вміст фосфату, іонів марганцю, заліза
і цинку в середовищі. Дефіцит фосфату призводить до надпродукції
цитрату. Роль іонів металів до кінця не
встановлена. Вважають, що дефіцит іонів металів впливає на властивості
клітинних мембран і морфологію гіф.
Процес ферментації, який призводить, до
утворення лимонної кислоти проводять при низьких значеннях рН
(3-4), що полегшує підтримку стерильних умов ферментації і зменшує можливість
утворення побічних продуктів. У більш лужному середовищі відбувається
накопичення щавлевої і глюконової кислот.
Припускають, що в кислому середовищі стимулюється гліколіз, що забезпечує
напрямок потоку вуглецю в цикл Кребса.
Живильні середовища для культивування
продуцентів лимонної кислоти як джерело вуглецю містять дешеву вуглеводну
сировину: мелясу, крохмаль і глюкозний сироп. Гриб Аspergillus niger, найчастіше вирощують на мелясі. Гриб Тrichoderma viride синтезує значну кількість цитрату з
глюкози, що дозволяє використовувати і целюлозу. Запропоновані штами бактерій (Сorynebacterium, Arthrobacterium, Вrevibacterium) і дріжджів роду Сапdidа, що здійснюють процес на основі н-парафінів
(С9-С30), які поки широко не використовуються в
промисловості.
Існує декілька технологічних варіантів
промислового виробництва лимонної кислоти. Спочатку був розроблений варіант
процесу, що грунтується на поверхневій ферментації,
пізніше - на глибинному культивуванні. Останнє ведеться в дві стадії: на першій
проходить ріст міцелію, а на другій,
після виходу культури в стаціонарну фазу - інтенсивний синтез лимонної кислоти.
В кінці ферментації масу міцелію відокремлюють шляхом фільтрування і
промивають. Потім при рН < 3,0 у вигляді
кальцієвої солі осаджують щавлеву кислоту, а з маточного розчину виділяють
лимонну кислоту у формі середньої солі, що кристалізується в комплексі з
чотирма молекулами води. Вільну кислоту виділяють з промитих кристалів солі
після їх обробки сульфатом кальцію. Високоочищені
препарати лимонної кислоти отримують після додаткової процедури очищення
методом іонообмінної хроматографії. Вихід продукту становить 85 відсотків.
В 20-х роках XX століття налагоджено
промислове виробництво D-глюконової кислоти з глюкози при участі
Аspergillus niger. При цьому за 48 годин ферментації
культури гриба ступінь перетворення субстрату становить 90%. Глюконат натрію, у вигляді якого зазвичай виділяють глюконову кислоту, використовують для вилуговування
металів, боротьби з іржею, як миючий засіб і як медичний препарат. За участю
культури грибів з роду Аspergillus шляхом ферментації глюкози отримують з високим виходом іта-коновую кислоту, що використовується для виробництва
пластмас і фарбників.
Нові можливості для інтенсифікації
виробничих процесів отримання органічних кислот відкриває застосування
іммобілізованих ферментів і клітин мікроорганізмів.
15.2. Біотехнологія отримання
вторинних метаболітів
Із всіх продуктів,
що синтезуються за допомогою мікробіологічних процесів, найбільше значення
мають вторинні метаболіти (ідіоліти). Це - низькомолекулярні
сполуки, для розмноження яких не потрібна чиста культура. Вони виробляються
обмеженим числом таксономічних груп і часто є сумішшю близькоспоріднених сполук, що відносяться до однієї і тієї ж хімічної групи. Якщо питання про фізіологічну роль вторинних метаболітів
в клітинах-продуцентах було предметом
дискусій, то їх промислове отриман-ня
представляє певний інтерес, оскільки вони є біологічно активними речовинами:
одні з них володіють антимікробною активністю, інші є специ-фічними
інгібіторами ферментів, треті - ростовими чинниками, а окремі з них і
фармакологічною активністю. До вторинних метаболітів відносяться антибіотики,
алкалоїди, гормони росту рослин і токсини. Фармацевтична промисловість розробила
надскладні методи скринінгу (масової перевірки) мікроорганізмів на здатність
продукувати цінні вторинні метаболіти. Отримання такого роду речовин стало
основою для створення ряду галузей мікробіологічної промисловості, зокрема
пеніциліну. Його мікробіологічний спосіб отримання розроблений в 1940-х роках
минулого століття і заклав фундамент сучасної промислової біотехнології.
Принципи отримання вторинних метаболітів засновані на особливостях їх синтезу клітинами мікроорганізмів.
Біосинтез вторинних метаболітів фазоспецифічний і
проходить після закінчення стадії росту, в ідіофазі,
завдяки чому їх ще називають ідіолітами. Серед
вторинних метаболітів провідне місце за
об'ємом виробництва займають антибіотики.
15.2.1. Отримання антибіотиків.
Антибіотики - органічні сполуки, які синтезуються живою клітиною і
здатні в невеликих концентраціях сповільнювати розвиток або повністю зни-щувати чутливі до них види мікроорганізмів. Їх
продукують не лише клітини мікроорганізмів і рослин, але і тварин. Антибіотики
рослинного походження називають фітонцидами (хлорелин,
томатин, сативин, що
отримується з часнику, і алін, що виділяється з
цибулі). Це - найбільший клас фармаколо-гічних
препаратів, які синтезуються мікроорганізмами. Деякі з них викорис-товуються
в сільському господарстві у боротьбі із сільськогосподарськими шкідниками (поліоксин, барідоміцин, носгаліцин), інші - в медичних цілях (пеніцилін,
тетрациклін, цефалоспорин та інші).
Молекули
антибіотиків різноманітні по складу і механізму дії на мікробну клітину. При
цьому у зв'язку з виникненням стійкості патогенних мікроорганізмів до старих
антибіотиків постійно існує потреба в нових. В деяких випадках природні
мікробні антибіотичні продукти хімічним або ензиматичним шляхом можуть бути
перетворені на так звані напівсинтетичні антибіотики, що володіють високими
терапевтичними властивостями.
Антибіотики виробляються мікрорганізмами в результаті спільної дії продуктів 10-30
генів, що затрудняє використання генно - інженерних підходів для управління їх
синтезом. Проблему вирішують
синтезом амінокислот який визначається мультиферментним комплексом що кодуєть- ся одним
опероном (наприклад, у випадку
аміно-кислот пептидної природи).
Введення відповідних генів із одного мікроорганізму в інший близько-родний, може призвести до отримання “гібридного” антибіотика із новими властивостями. Цей підхід успішно застосований в 1988 році біохіміком Міхаелом Хондвудом в США. При об’єднані генів біосинтезу актинородину та медерміцину отриманий новий антибіотик “медерродін”.
Шість родів
фармацевтичних грибів продукують біля 1000 різних ан-тибіотиків
значну частину з яких синтизують актиноміцети (один
тільки вид Streptoomyces qriiiseum виробляє біля 50 видів антибіотиків). В практиці реально
використовують незначну кількість із відомих науці антибіотиків, які виробляють
мікроорганізми. Це - пеніциліни і цефалоспорини, які проду
- куються грибами родів Penicillum та Cephalosporum: стрептоміцин, гентамі-цин,
еритроміцин та тетрациклін, які синтезуються актиноміцетами роду Streptomyus та бактеріями родів Micromonosporata Bacillus, та деякі інші.
У світі щорічного виробляється
антибіотиків майже на 20 млрд. доларів. До антибіотиків належать найважливіші
протимікробні і протипухлинні препарати. Відкриття антибіотиків провело
переворот в лікуванні інфекційних захворювань. Відійшли в минуле уявлен-ня про невиліковність багатьох бактеріальних
інфекцій (туберкульоз, сепсис, сифіліс...). Антибіотики застосовують у ряді
галузей народного господарства (рослинництво, тваринництво, ветеринарія,
харчова промисловість, медици-на). Організація
промислового виробництва антибіотиків зіграла вирішальну роль в становленні
промислової біотехнології.
До антибіотиків відносяться
низькомолекулярні ефектори спочатку природного походження,
здатні пригнічувати ріст живих клітин. Антибіо-тики,
що продукуються рослинними об'єктами, називають фітонцидами. Питання про
фізіологічні функції антибіотиків, їх місці в метаболізмі і процесах еволюції
остаточно не вирішене. Антибіотики використовують в боротьбі за існування грунтових біоценозів, тому багато з них є засобами захисту, тобто є
своєрідною хімічною «зброєю» клітин.
Вони беруть участь в процесах детоксикації шкідливих метаболітів, контролюють обмін речовин
і процеси розвитку (диференціювання клітин), служать запасними живиль-ними речовинами. Деякі вчені розглядають антибіотики
як випадкові речо-вини, що володіють корисними
властивостями, інші вважають їх реліктовими молекулами, витисненими в ході
еволюції продуктами рибосомального син-тезу, які і до
цього часу зберегли здатність втручатися в біохімічні процеси.
Здатність нитчастого гриба зеленої цвілі
Реnicillum notatum викликати загибель мікроорганізмів
вперше була встановлена в 1928 році англійським мікробіологом А. Флеммінгом. Проте її лікувальні властивості були описані ще
в 1871 році російським дерматологом А.Р. Полотебновим.
Кількість антибіотиків, що синтезуються, постійно зростає. У 1940 році було
відомо всього 6 антибіотиків, а в даний час описано більше 12000 аналогічних сполук, з яких в клініці застосовують близько 200
препаратів. 97% відомих антибіотиків токсичні, тому в практиці не
використовуються. У хімічному відношенні вони представляють збірну групу
органічних речовин. Залежно від хімічної природи і ряду інших властивостей
відомі антибіотики поділяють на класи:
- б-лактамні (пеніциліни, цефалоспорини) становлять більше 50% ринку антибіотиків;
- тетрациклін (тетрациклін, морфоциклін, метациклін);
- макроліди
(еритроміцин, олеандоміцин);
- міноглікозиди
(гентаміцин, амікацин);
- глікопептиди
(ванкоміцин, ристоміцин);
- амфеніколи
(левоміцетин);
- лінкосаміди
(лінкоміцин);
- полієнові
[протигрибкові (ністатин, леворин)];
- протипухлинні (блеоміцин)
і ін.
За типом дії антибіотики ділять на
бактерицидні (лактамні, аміногліко-зиди),
які викликають загибель мікроорганізмів, і бактеріостатичні (макро-ліди, тетрациклін, левоміцетин) - порушують здатність
мікроорганізмів ділитися. По спектру дії розрізняють антибіотики вузької і
широкої дії. До останніх відносять тетрациклін, макроліди,
аміноглікозиди, які особливо корисні у разі
неідентифікованих збудників хвороби, проте при тривалому застосуванні
викликають у пацієнтів дисбактеріоз.
Останніми роками досягнуті значні успіхи
в розшифруванні молекуляр-ного механізму дії
антибіотиків. Найбільш яскрава особливість антибіотиків - виняткова
специфічність їх дії. По виразу П. Ерліха,
антибіотики - це магічні кулі. Специфіка їх дії
полягає у вибірковому придушенні ефекторами одного або декількох процесів лише у деяких мікроорганізмів.
Таким чином, антибіотики блокують метаболічні мішені в клітинах-мішенях.
Залежно від специфіки дії антибіотиків на молекулярному рівні розрізняють
наступні групи сполук, що викликають у бактерій:
- порушення біосинтезу пептидогліканів клітинної стінки (пенициліни,
ванкоміцин, цефалоспорини);
- порушення окремих етапів процесів
трансляції (амфеніколи, аміноглікозиди,
тетрациклін, макроліди, лінкосаміди);
- пошкодження мембрани цитоплазми (граміцидин, поліміксини);
- порушення біосинтезу нуклеїнових
кислот (рифаміцини, актиноміцин, протипухлинні антибіотики);
- порушення енергетичного обміну (олігоміцин, хлоргексидин).
Антибіотики широко використовують як
молекулярні інструменти при дослідженні фундаментальних проблем біології,
таких, як розшифровка якнайтонших механізмів
біосинтезу білку, нуклеїнових кислот і структури клітинних стінок бактерій,
створення моделей транспорту іонів через біологічні мембрани.
Синтез нових антибіотиків обумовлений як
потребами практики, так і накопиченням резистентних форм мікроорганізмів по
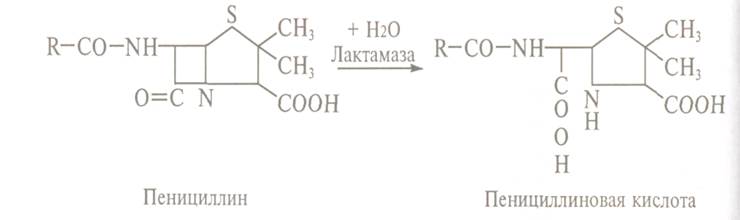
відношенню до багатьох антибіотиків. Стійкість бактерій до пеніцилінам і
цефалоспоринам створює присутній в їх клітинах ензим лактамаза
(пеніциліназа). Фермент гідролізує
амідний зв'язок б-лактамного
циклу в молекулі антибіотика з утворенням кислоти Пеніциліну, яка повністю позбавлена
антимікробної активності:
Вивчення об'єму і потенціалу захисних
властивостей мікроорганізмів показало, що їх резистентність до антибіотиків має
глобальний характер і забезпечується як різноманітністю фенотипів
резистентності, так і різноманітністю і стабільністю систем горизонтального
генного транспорту. Тому головний напрямок отримання нових антибіотиків полягає
не у відкритті нових сполук, а в хімічній
трансформації природних молекул для створення напівсинтетичних антибіотиків, що
характеризуються значно меншою резистентністю і токсичністю, але ширшим
спектром дії, тривалим життям, хімічною
і біологічною стійкістю. Важливий підхід на шляху отримання стійких аналогів
антибіотиків - використання природних інгібіторів б-лактамаз
- клавуланової і оливанової
кислот.
Методи отримання антибіотиків шляхом
хімічного синтезу надзвичайно складні і не можуть конкурувати з їх біосинтезом
методами біотехнології. Існує декілька способів отримання як природних, так і
напівсинтетичних антибіотиків. Направлений біосинтез антибіотиків відбувається
шляхом прямої ферментації мікроорганізму - продуцента з відповідним
попередником, що індукує синтез ферментів вторинного метаболізму в ідіофазі. Точний механізм індукції первинними метаболітами генів, що кодують синтез ферментів
вторинного метаболізму, не розшифрований, проте встановлено, що молекули
попередника необхідно додавати в середовище в період фази росту
мікроорганізмів. Встановлено, що попередник, що вводиться, повинен лімітувати
швидкість біосинтезу антибіотика. Наприклад, виробництво бензилпеніциліну
в значній мірі стимулюється добавками його метаболічного попередника - фенілоцетової кислоти; пропіонова
кислота і пропиловий спирт ініціюють біосинтез макролідів через метилмалонілКоА;
L-фенілаланін - попередник фенілалані-ну
- прискорює утворення граміцидину S. Аналогічний ефект викликає
використання інгібіторів метаболізму. Так, при придушенні процесу введення
хлору мікроорганізм S. аureofaciens утворює тетрациклін, а не хлортетрациклін, а при інгібуванні
реакції метилування ним синтезується деметиліровані
похідні хлортетрацикліну.
Інший спосіб отримання антибіотиків
полягає у використанні для їх біосинтезу блокованих мутантів, у яких відсутня
(блоковано) певна ланка в ланцюзі реакцій, ведучих до синтезу антибіотика.
Блоковані мутанти не здатні утворювати потрібний антибіотик. Використовуючи
низьку субстрат-ну специфічність ферментів вторинного метаболізму і вводячи
аналоги попередників антибіотика, останні переводять в аналоги самого
антибіотика в ході процесу, відомого як мутаційний біосинтез, або мутасинтез:
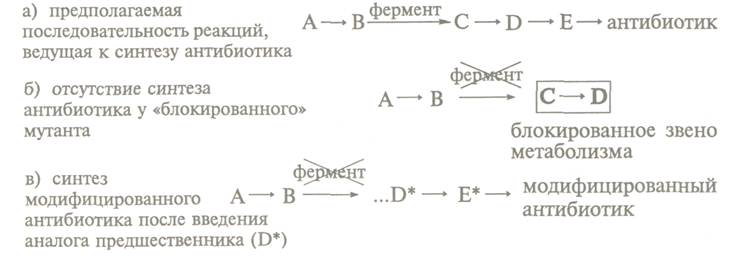
Так, мутанти Nocardia mediterranei, у яких порушена здатність до
ацилування, утворюють аналог попередника рифаміцину
В-ріфаміцин SV, який є початковою речовиною для отримання
багатьох синтетичних рифаміцинів (препарати для
лікування туберкульозу і прокази).
Особливо успішні розробки в напрямку
біосинтезу напівсинтетичних пеніцилінів і цефалоспоринів. Отримання нових ефективніших аналогів пеніциліну засноване на
зміні природи його ацильного угрупування при
збереженні в незмінному вигляді ядра пеніциліну - 6-амінопеніциланової кислоти
(6-АПК). У промисловості 6-АПК отримують шляхом гідролізу природних пеніцилінів
за допомогою специфічного ферменту - пеніцилінацилази,
що синтезується з виходом в процесі ферментації ряду штамів мікроорганізмів. Ацилази розрізняють по їх субстратній
специфіч-ності. Деякі з ацилаз
здатні каталізувати і зворотні реакції - процеси
ацилування аміногрупи 6-АПК з утворенням модифікованого пеніциліну. Таким
шляхом отримано більше 40 000 напівсинтетичних пеніцилінів. Істотно, що у
багатьох випадках 6-АПК не виділяють з культуральної
рідини, наприклад при перетворенні бензилпеніциліну
на ампіцилін:
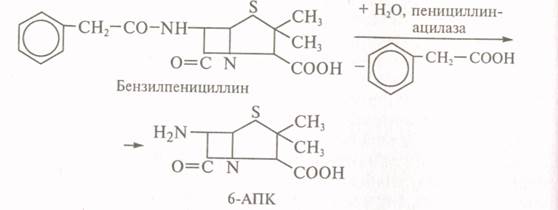
Бензілпеніцилін
гідролізують ацилазою
мутанта Kluyvera citrophila при рН
7,8 - 8,0 і температурі 40 – 500С. Потім у ферментер вводять мутант Рseudomonas melanogenum і фенілгліцин.
Умови ферментації змінюють так, щоб ацилаза другого
організму мутанта здійснювала синтез ампіциліну:
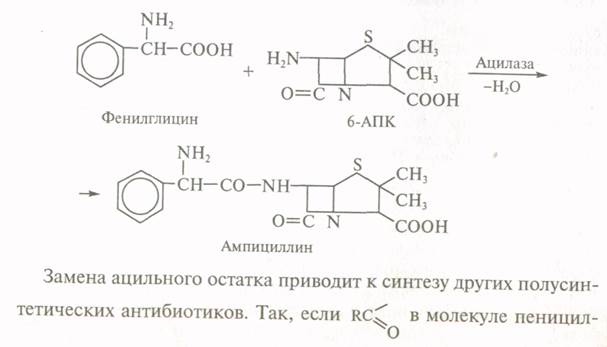
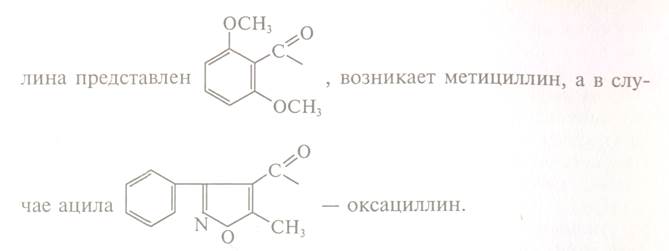
Антибіотики продукуються плісневими грибами, актиноміцетами, еубактеріями та іншими мікроорганізмами. Деякі з них здатні продукувати значну кількість антибіотиків. Так, 6 родин філаментозних грибів виробляють біля 1000 антибіотиків, в тому числі пеніцилін і цефалоспорин,
а три родини актиноміцетів - 3000 антибіотиків. Серед актиноміцетів найбільший внесок роду Streptomyces, один з видів якого - Streptomyces griseus синтезує більше 50 антибіотиків. В процесі утворення антибіотиків задіяно значну кількість генів. Массовая росшифровка первинної структури геномів мікроорганізмів показала, що ця величина рівна 1-2%. Так, у Вacillus subtilis число таких генів сягає 2%, що забезпечує мікроорганізму можливості для захисту і адаптації. З іншого
боку, ця обставина затрудняє аналіз біосинтезу антибіотиків і ідентифікацію окремих мутацій, здатних підвищити вихід продукту.
Біосинтез антибіотиків, як і будь-яких
інших вторинних метаболітів, зростає у фазі сповільненого росту клітинної
популяції (кінець трофофази) і сягає максимуму в
стаціонарній фазі (ідіофазі). Вважають, що в кінці трофофази змінюється ензиматичний статус клітин, з'являються
індуктори вторинного метаболізму, що звільняють гени вторинного метаболізму
з-під впливу катаболітичної репресії. Тому будь-які
механізми, гальмуючі клітинну проліферацію і активний ріст, стресові ситуації,
активують процес утворення антибіотиків.
Процес культивування ідіолітів проходить дві фази (двоступінчате культивування). На першій фазі
відбувається накопичення достатньої кількості біомаси, яка вирощується на
середовищі для росту мікроорганізму. Ця фаза повинна бути швидкою, а живильне середовище
дешеве. На другій фазі здійснюються запуск і активний синтез антибіотика. На
цій фазі ферментацію проводять на продуктивному середовищі.
Утворення антибіотиків регулюється
умовами культивування мікроор-ганізмів. Тому оптимізація живильного
середовища є головним чинником в підвищенні виходу продукту.
Результати досліджень показали, що вихід
цефалоспорина С зменшу-ється при переході від використання як
джерела вуглецю сахарози до швидко засвоюваного вуглеводу глюкози. Найбільш
оптимальним середовищем для синтезу антибіотика культурою Streptomyces antibioticum виявилася суміш 0,1% глюкози і 1% галактози. При такому
співвідношенні глюкоза швидко утилізується і мікроорганізми переорієнтовуються
на засвоєння галактози, що і ініціює ідіофазу.
Значна частина антибіотиків беруть свій
початок від проміжних сполук обміну первинних
метаболітів, тому їх біосинтез регулюється шляхом ретроінгібірування.
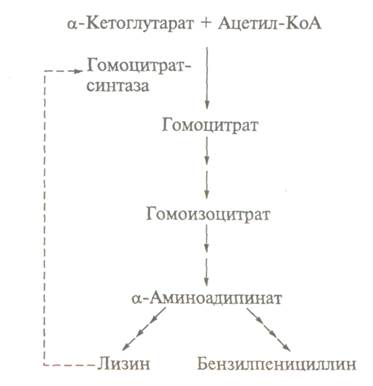
Так, біосинтез пеніциліну культурою гриба Реnicillium chrysogenum контролюється за принципом
зворотного зв'язку L-лізином. Цей ефект пояснюється тим, що біосинтез як пеніциліну,
так і лізину здійсню-ється через загальний попередник
- а-аміноадипінову
кислоту. Гальмування лізином першого ферменту біосинтезу - гомоцитратсинтази
- призводить до нестачі а-аміноадипінової кислоти, що знижує вихід антибіотика.
Введення в живильне середовище а-аміноадипінової
кислоти запобігає інбігуючий ефект лізину, що
інгібує, і активує біосинтез пеніциліну у відсутності лізину. Окрім ретроінгібірування біосинтез багатьох антибіотиків
гальмується високими концентраціями своїх же антибіотиків. В процесі еволюції
мікроорганізми виробили механізми захисту від дії власних антибіотиків. Ця
проблема успішно вирішується в результаті використання іммобілізованих
ферментів.
Більшість антибіотиків синтезують при
глибинній аеробній ферментації періодичної дії в асептичних умовах. Період
ферментації триває 7-10 діб. Останніми роками впроваджуються напівбезперервні і безперервні процеси ферментації.
Технологія завершуючих стадій процесу визначається
природою антибіотика, характером виробництва і цілями подальшого використання
антибіотиків. Для медичних цілей технологія виділення і очищення має особливе
значення. Зазвичай вона включає складні багатоступінчаті комбінації різних
операцій: екстракцію антибіотиків відповідними розчинниками, осадження і
перекристалізацію їх з різних середовищ, фракціонування на іонообмінних смолах,
ліофільну сушку готових препаратів. Антибіотики виділяють або у вигляді
порівняльних неочищених препаратів (натрієва сіль пеніциліну), або у вигляді високоочищених речовин (прокаїнова
сіль пеніциліну), призначених для клінічного використання. Вихід антибіотиків
зазвичай становить декілька десятків грамів на
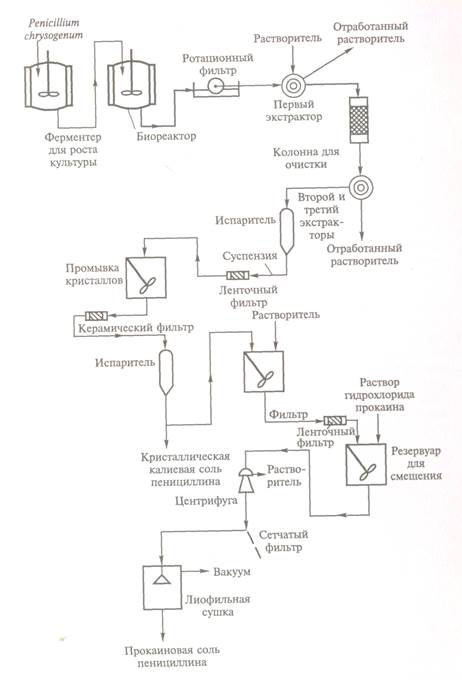
Рисунок 15.1.1.1.4. Технологічна схема виробництва пеніциліну
(по В.Агишоп, Р.Маукипа, 1983)
15.2.2. Отримання промислово
важливих стероїдів.
Здатність клітин мікроорганізмів до
складних процесів біотрансформації найбільш повно
реалізується при отриманні промислово важливих стероїдів. Використання
абсолютної субстратної специфічності і стереоспецифічності біологічних каталізаторів, якими
володіють клітини мікроорганізмів, дозволило розробити умови проведення
багатьох хімічних реакцій для структурної перебудови стероїдів. В результате були отримані нові
сполуки з кращими фармакологічними властивостями. Біотрансформація стероїдів полягає в селективній дії на одне з положень стероїдного скелету. Перший промисловий
процес мікробної біотрансформації стероїдів базується на тех-нології направленого гідроксилювання (11-а-гідроксилювання) прогестерону:
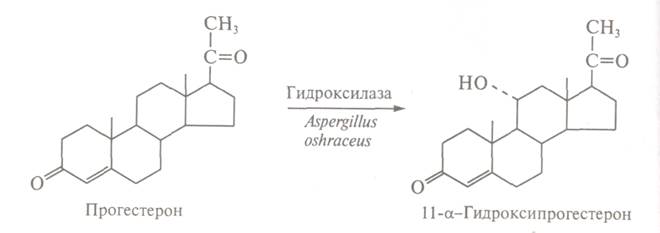
Значимість розробленої мікробної
трансформації визначається тим, що процеси гідроксилювання
кортикостерону і його похідних лежать в основі
промислового отримання багатьох цінних продуктів: протизапальних і
протипухлинних препаратів, трансквилізаторів, анестизующих засобів, статевих гормонів.
Так, виробництво в промисловому масштабі
важливого протизапального препарату - преднізолону - здійснюється шляхом
мікробного гідроксилюван-ня кортикостерона.
Правильність перетворення стероїдного
субстрату контролюють, поєдну-ючи хімічний підхід із
специфічністю біологічної системи. Наприклад, утворення оцтовокислого ефіру по
С-17-субстрату стереохімічно перешкод-жає іншим побічним реакціям.
Найважливіше джерело стероїдних гормонів
- культура клітин рослин. Так, культура клітин диоскореї
дельтовидної кореневого походження продукує фітостерин діосгенін і його глікозидні похідні (сапоніни).
Істотно, що здатність до надсинтезу фуростанолових глікозидів ряду штамів диоскореї,
наприклад штаму ДМ-ОГ, стабільно підтримувалася протягом 27 років. Таким чином,
культивуванням клітин рослин in vitro є нове вирішення
проблеми промислового отримання вторинних метаболітів.
Подальші успіхи у виробництві стероїдних
препаратів пов'язують із застосуванням іммобілізованих клітин, використанням оптимального поєднання біологічних і
хімічних перетворень, а також з вдосконаленням технології очищення отримуваних сполук. Середовища для біотрансформації
мають достатньо складні компоненти, а реакція вимагає суворого контролю за
кожним її параметром (рН, час і так далі). Так, середовище для проведення реакції
окислення кортизолу в преднізолон культурою клітин Аrthrobacter simpelex включає пептон, глюкозу і
кукурудзяний екстракт. Через добу до суміші додають речовину S Рейхштейна. Процес ведуть суто в
нейтральному середовищі при температурі 28°С протягом 120 годин. Вихід
преднізолону становить 93 відсотки.
Розробка промислового виробництва
преднізолону шляхом біотрансфор-мації стероїдів
дозволила понизити вартість препарату в 200 разів.
Запитання для котролю: