Лабораторна
робота № 1
Дослідження складу продуктів горіння
речовин
Мета роботи. Теоретично і
експериментально визначити склад продуктів і встановити граничну за горючістю
концентрацію кисню.
Зміст роботи. 1. Провести
спалювання горючої речовини в ізольованій ємкості. Визначивши масу згорілої
речовини, розрахувати коефіцієнт надлишку повітря і склад продуктів горіння,
виходячи з хімічного рівняння реакції горіння.
2. Методом
газової хроматографії встановити склад продуктів горіння, що знаходяться в
закритій ємності, після припинення горіння. На підставі отриманих даних
розрахувати коефіцієнт надлишку повітря.
3. Порівняти
розрахункові та експериментальні дані, отримані в ході виконання лабораторної
роботи, зробити висновки. Звернути увагу на отримане значення граничної за
горючістю концентрації кисню, тобто тієї концентрації кисню, при якій горіння
дослідженої речовини в закритій ємності припинилося.
Введення. Склад продуктів
горіння є важливою характеристикою пожежної небезпеки речовин і матеріалів, так
як в умовах пожежі від нього залежить токсичність середовища, а це, в свою
чергу, впливає на безпеку і здоров’я людей, що опинилися в зоні задимлення.
В основі процесу
горіння лежить хімічна взаємодія горючої речовини і окислювача. При горінні
речовин у повітрі окислювачем є кисень. Азот, що міститься в повітрі , не бере
участі в хімічному перетворенні. Так як повітря містить ~ 21 % кисню і ~ 79 %
азоту, то на кожен моль кисню в повітрі доводиться 3,76 моля азоту. Тому при
складанні рівняння матеріального балансу процесу горіння в повітрі перед азотом
записують коефіцієнт 3,76. Наприклад, для етану:
С2Н6
+ 3,5 О2 + 3,5 × 3,76 N2 = 2 СО2 + 3 Н2О
+ 3,5 × 3,76 N2.
Склад продуктів
горіння в першу чергу залежить від природи горючої речовини, тобто його
елементарного складу. Наприклад, для речовин, що містять вуглець, водень, хлор,
продуктами повного окислення є двоокис вуглецю, вода, хлористий водень. Крім
цього, на склад продуктів горіння будуть впливати умови, за яких відбувається
горіння. У разі нестачі кисню поряд з вище переліченими продуктами утворюються
продукти неповного окислення: окис вуглецю ( СО) і вуглець (С ) у вигляді сажі.
Кількість повітря,
необхідного для повного згоряння деякої кількості речовини, розраховують з
рівняння матеріального балансу.
Відношення фактичної
кількості повітря, що міститься в певному об’ємі, до
розрахункового, тобто теоретично необхідного, називається коефіцієнтом надлишку
повітря:
![]()
При горінні газової
суміші горючої речовини та окислювача (кінетичне горіння) з α>
1 відбувається повне окислення горючої речовини. Причому, якщо α
> 1, то в продуктах горіння міститься надлишок повітря:
![]()
![]() , а ,отже , і
кисень.
, а ,отже , і
кисень.
Якщо α < 1 ,
то в продуктах горіння містяться продукти повного і неповного окислення.
У разі дифузійного
режиму горіння, яке найчастіше має місце на пожежі, навіть при надлишку повітря
можуть утворюватися продукти неповного горіння, так як реакція у полум’ї лімітується
процесом дифузії кисню повітря в зону горіння. У закритих приміщеннях горіння
припиняється при вмісті в повітрі 14-17 % кисню. При зниженні в приміщенні
концентрації кисню зменшується швидкість його «доставки» до зони горіння, а це
призводить до зменшення швидкості хімічної реакції, зниження температури
горіння і, за певних умов, до припинення горіння.
Метод газової
хроматографії.
Якісний і кількісний
аналіз продуктів горіння може бути проведений методом газової хроматографії.
Цей метод заснований на здатності речовин адсорбуватися на поверхні твердих
речовин.
Якщо в
хроматографічну колонку, яка являє собою трубку невеликого діаметру, заповнену
пористим сорбентом (речовини з великою питомою поверхнею: активоване вугілля,
цеоліти, силікагелі, ...), ввести деяку кількість індивідуальної газоподібної
речовини і продувати її інертним газом з постійною швидкістю, то ця порція
речовини буде переміщатися по колонці з меншою швидкістю, ніж інертний газ
(газ-носій). Швидкість переміщення речовини по колонці залежатиме від здатності
даної речовини адсорбуватися на сорбенті. Чим краще адсорбується речовина, тим
повільніше вона буде переміщатися.
Таким чином, якщо в
хроматографічну колонку ввести порцію суміші індивідуальних речовин, то при
русі по колонці суміш розділиться на індивідуальні компоненти. На рис. 1.1
показано поділ суміші, що містить кисень, азот і двоокис вуглецю в
хроматографічної колонці, заповненій цеолітом .
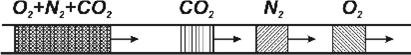
Рис. 1.1. Рух суміші
газів в хроматографічній колонці.
За цим рисунком можна
встановити, що з трьох газів найслабше на цеоліті адсорбується О2, а
найсильніше – СО2.
Після проходження
колонкою індивідуальні компоненти разом з газом-носієм потрапляють в детектор,
який фіксує зміну концентрації компонента. Робота детектора може ґрунтуватися
на різних фізичних принципах – вимірювання теплопровідності, щільності
іонізаційного струму і ін. Найбільш поширеним є детектор, що реєструє зміну
теплопровідності газу, такий детектор називається катарометром.
Детектор-
катарометр схематично показаний на рис. 1.2. Він має два канали, в яких
розташовані чутливі елементи – спіралі з тонкого дроту, нагрівання до високої
температури здійснюється електричним струмом.
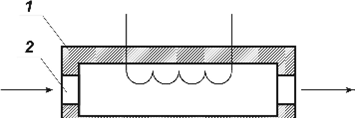
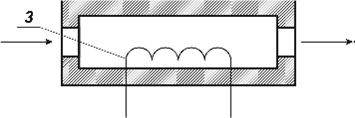
Рис . 1.2 . Схема
детектора-катарометра:
1 – корпус детектора;
2 – канали для газу; 3 – чутливі елементи.
Одним з каналів йде з постійною
швидкістю лише інертний газ (газ-носій), а по іншому з хроматографічної колонки
надходить газ-носій з розділеними компонентами суміші. Коли в обох каналах
знаходиться газ-носій, теплопровідність середовища близько спіралі однакова,
однакова і температура спіралей. Якщо в другий канал потрапляє будь-який з
компонентів суміші, то змінюється теплопровідність газу навколо спіралі, що
призводить до зміни її температури, а, отже, і до зміни опору спіралі. Виникає
дисбаланс в містку електричної схемі, в яку включені обидві спіралі.
Електричний сигнал, викликаний зміною теплопровідності в каналі катарометра,
подається через підсилювач на самописець. Чим більша концентрація речовини, що
проходить через детектор, тим більша величина електричного сигналу.
Електричні сигнали у
вигляді піків записуються на рухомому діаграмному папері. Отримана таким чином
картина називається хроматограмою. Для суміші, що містить О2, N2
і СО2 , хроматограма показана на рис. 1.3.
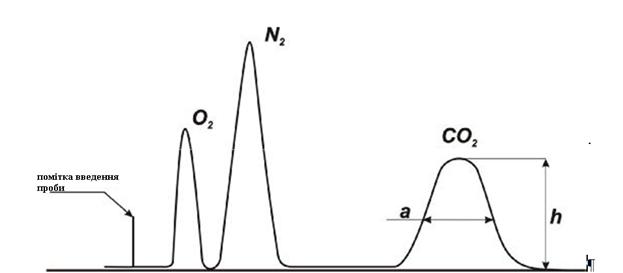
Рис. 1.3.
Хроматограма газової суміші.
Обробка хроматограм
дозволяє встановити якісний і кількісний аналіз досліджуваної суміші газів.
Площа кожного піку на хроматограмі пропорційна кількості відповідного
компонента в аналізованій пробі. Площа піку визначають як площу трикутника
добутком висоти піка на його ширину, виміряної на половині висоти.
Наприклад, для СО2
(рис. 1.3) S = a × hCO2 .
Для того, щоб порівнювати площі піків , що належать різним речовинам, необхідно
ввести поправки, що враховують пропорційність між концентрацією речовини в
детекторі і величиною електричного сигналу (для катарометра залежить від
теплопровідності аналізованої речовини), а також ступінь посилення електричного
сигналу, що надходить на самописець. Необхідна ступінь посилення сигналу
встановлюється ручкою подільника напруги на панелі хроматографа окремо для
кожного піку.
Тому при обрахунку
хроматограм для кожної речовини розраховують наведені площі піків з урахуванням
перерахованих вище поправок :
![]()
де Kпр
– коефіцієнт пропорційності, що враховує відмінність в теплопровідності
речовин;
Kу - коефіцієнт
посилення електричного сигналу.
Якщо відбір газової
проби продуктів згоряння проводиться при кімнатній температурі, то в цій пробі
практично відсутні пари води, що утворюються при горінні, так як вони
конденсуються при зниженні температури продуктів горіння нижче точки кипіння
води. Тому хроматографічний аналіз не може дати інформацію про кількості парів
води в продуктах горіння. Проте їх зміст можна розрахувати непрямим методом,
виходячи з рівняння реакції. наприклад, при згорянні етану в продуктах горіння
на два молі утвореного двоокису вуглецю припадає три молі води (див. рівняння
хімічної реакції). Таким чином, обсяг парів води в продуктах горіння в 1,5 рази
більший обсягу вуглекислого газу
. Тому, щоб врахувати
вміст води в продуктах горіння, водять величину
![]()
Тоді вміст ( % об. ) кожного
компонента в продуктах горіння визначиться за формулою:
φі=Si '/SΣ×
100 % , (1.3)
де SΣ - сума
приведених площ всіх речовин.
SΣ= SО2'+ SN2'+ SСО2'+ SН2О' (1.4)
Опис лабораторної
установки.
Установка для визначення складу продуктів горіння зображена на рис. 1.4.
Фарфоровий тигель 1 з
досліджуваною речовиною поміщається на підставці 2 і герметично закривається дзвоном
3 прямокутної форми. Дзвін зроблений з органічного скла, на одній його стороні
закріплена еластична компенсуюча ємність 4 (гумова кулька), призначена для
збереження атмосферного тиску в замкнутій ємності, так як горіння
супроводжуватиметься зміною обсягу за рахунок протікання хімічної реакції і
підвищення температури. На іншій стороні дзвону закріплено спеціальний пристрій
5, через який медичним шприцом відбирається газова проба продуктів горіння. Для
аналізу використовують газовий хроматограф, що складається з наступних основних
частин: балона 6 з газом-носієм,
регулятора витрати газу-носія 7, пристрої для введення проби 8,
хроматографічної колонки 9 , детектора 10 і самописця 11 типу КСП.
![]()
![]()
![]()
![]()
Рис. 1.4. Схема
установки для визначення складу продуктів горіння:
1 - тигель з
досліджуваної рідиною; 2 – підставка; 3 - дзвін; 4 - еластична ємність; 5
пристрій для відбору проби; 6 - балон з інертним газом; 7 - вентиль тонкого
регулювання;8 - пристрій для введення проби; 9 - хроматографічна колонка;10 - детектор;
11 - самописний прилад.
Порядок виконання
роботи та проведення розрахунків .
1. Досліджувану горючу рідину
наливають у тигель і зважують її разом з тиглем на вагах з точністю 0,01 г.
2. Поміщають тигель на підставку
лабораторної установки, підпалюють горючу рідину і швидко накривають дзвоном
так , щоб горіння відбувалося в герметичній ємності. Спостерігають за горінням
рідини.
3. Після припинення горіння через
спеціальний пристрій на дзвоні медичним шприцом відбирають газову пробу
продуктів горіння і вводять в хроматограф .
4. Після отримання хроматограми дзвін
знімають, повторно зважують тигель з рештою речовиною і за різницею мас
визначають кількість згорілої рідини (втрату маси Δm).
5. Записують рівняння горіння
досліджуваної речовини та проводять розрахунок теоретичної кількості повітря Vпов, необхідного для
згоряння речовини масою Δm.
![]()
У даній роботі для
зручності рекомендується проводити розрахунки маси в грамах, а об’єму в літрах.
У цьому випадку Vo=22,4
л/моль, а Мг виражатиметься
в г/моль.
6. Розраховують коефіцієнт надлишку
повітря α, прийнявши практичну
кількість повітря Vпов
рівним об’єму камери , в якій відбувалося горіння:
![]()
7. Виходячи з рівняння реакції
горіння, розраховують кількість речовин, що утворилися – двоокису вуглецю і
води при згорянні горючої речовини, а також кількість азоту і кисню в продуктах
горіння
![]() m;
m; ![]() m;
m; ![]() ;
;
![]()
де
![]() .
.
8. Розраховують відсотковий склад
продуктів горіння і заносять отримані результати в табл. 1.1.
Таблиця 1.1
|
Втрата маси, Δm, г |
Розрахункові дані
по складу ПГ, % об. |
Коефіцієнт надлишку повітря
α |
|||
|
СО2 |
Н2О |
N2 |
О2 |
||
|
|
|
|
|
|
|
|
Експериментальні
дані по складу ПГ, % об. |
Коефіцієнт надлишку повітря
α |
||||
|
СО2 |
Н2О |
N2 |
О2 |
||
|
|
|
|
|
|
|
9. Приступають до обробки даних
хроматографічного аналізу складу продуктів горіння. За хроматограмою визначають
відсотковий склад продуктів горіння. Отримані експериментальні дані заносять в
табл. 1.1.
10. Користуючись експериментально
встановленим вмістом кисню в продуктах горіння, визначають коефіцієнт надлишку
повітря:
![]()
11. Порівнюють розрахункові та
експериментальні дані, роблять висновки. Звернути увагу на отримане значення
концентрації кисню, при якому горіння припинилося.
У звіті з
лабораторної роботи приводять найменування речовини, хімічну формулу, умови
проведення досліду (температура навколишнього повітря – Т, К, атмосферний тиск
– Р, Па), розрахунок складу продуктів горіння і коефіцієнта надлишку повітря.
До звіту додають хроматограму продуктів горіння.
Контрольні
питання
1. Які
продукти горіння Ви знаєте? Які фактори роблять вплив на склад продуктів
горіння ?
2. Що таке коефіцієнт
надлишку повітря і як він розраховується?
3. Дайте
визначення повного і неповного горіння; в яких умовах утворюються продукти
неповного горіння. Чи здатні вони в певних умовах горіти?
4. Як впливає
вміст кисню в повітрі на здатність речовин до горіння ? Чому?
5. Чому в
замкнутому об'ємі горіння твердих і рідких речовин припиняється за наявності
певного вмісту кисню ?
6 . Вкажіть ,
який тип горіння реалізується при спалюванні горючої рідини в замкнутому об'ємі
в умовах досвіду, проведеного при виконанні лабораторної роботи?
7. У чому
полягає сутність хроматографічного методу аналізу суміші речовин?
8. Як працює
детектор-катарометр?
9. Чому при
хроматографическом аналізі не реєструється вміст пари води в продуктах горіння?
10. Які
поправки і чому слід вводити при розрахунку складу продуктів горіння по
хроматограмі?
11.
Визначити кількість згорілої речовини в
закритому об'ємі V ,якщо відомо, що вміст кисню знизився до φО2.
12.
Розрахувати кількість і склад продуктів горіння, що утворюються при згорянні
речовини масою Dm , якщо відомі температура горіння Тг і
коефіцієнт надлишку повітря α.

