Практична
робота №7
Тема: Визначення максимального тиску парів
речовини.
Мета:
ознайомити студентів з порядком визначення тиску вибуху.
7.1.
Поняття тиску вибуху
Технологічні
процеси, пов’язані із застосуванням чи синтезом горючих газів та рідин, можуть
супроводжуватися утворенням сумішей горючих газів та парів з повітрям. Такі
суміші є особливо небезпечними, оскільки можуть спровокувати виникнення пожеж
та вибухів.
Горючі
гази та пари, які знаходяться у закритій посудині чи апараті, не змішані з
повітрям, не здатні горіти. Якщо ж такі пари і гази випустити з посудини в
атмосферу і в місці витоку їх підпалити, то вони горітимуть у вигляді факела. В
цьому випадку швидкість горіння набуває максимальних значень. Згоряння сумішей
з такою швидкістю супроводжується виділенням значної кількості тепла за одиницю
часу і, відповідно нагріванням продуктів горіння до високої температури.
Вибух – це
надзвичайно швидке хімічне або фізичне перетворення речовин, що супроводжується
виділенням великої кількості теплової енергії, газів, як наслідок, різким
зростанням тиску і виникнення ударної (вибухової) хвилі, що в результаті
призводить до травмування людей, виникнення пожеж та руйнування конструкцій.
Виходячи
з процесів, що викликають вибух, розрізняють фізичний, хімічний та ядерний
вибухи. У курсі вивчення дисципліни мова йдеться про хімічні вибухи, тобто ті,
що пов’язані з горінням.
Вибух
складається з трьох стадій:
1)
перетворення хімічної енергії реакції на
теплову енергію;
2)
перетворення теплової енергії на енергію сильно
стисненого газу;
3)
поширення стисненого газу у вигляді ударної
хвилі.
Горюче
середовище може спалахнути не лише при введенні його в нагріту посудину.
Можливий і інший режим займання, вже не самовільного, а вимушеного – при
нагріванні горючого середовища в посудині з холодними стінками шляхом швидкого
стиснення. При достатньому нагріванні починається реакція, що самоприскорюється, тобто відбувається тепловий вибух. Таке
спалахування унаслідок нагрівання адіабатичним стисненням інколи називають
адіабатичним займанням.
В
цьому випадку газ нагрівається внаслідок стиснення ударною хвилею, що виникає
при швидкому згорянні.
До
параметрів тиску вибуху, що враховуються при характеристиці речовин та
матеріалів, відносять максимальний тиск вибуху і швидкість його наростання.
Під
максимальним тиском вибуху розуміють
найбільший тиск, який виникає при дефлаграційному
згорянні найбільш пожежовибухонебезпечної газо-,
паро-, пилоповітряної суміші у замкнутій посудині при
її початковому тискові 101,3 кПа.
7.2.
Методика визначення максимального тиску вибуху
Тиск
при вибуху газоповітряної суміші в закритому об’ємі визначається температурою
вибуху і відношенням числа молекул продуктів згоряння до числа молекул
початкової суміші. При вибуху газових сумішей тиск в більшості випадків не
перевищує 101,3 кПа, при умові, що початковий тиск суміші був нормальним.
Тиск
при вибуху газоповітряних сумішей визначають за формулою:
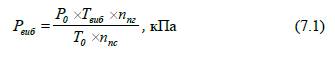
де Т0– початкова
температура суміші, К;
Твиб– температура вибуху, К; Р0–
початковий тиск суміші, кПа;
nпг – кількість молів продуктів реакції горіння,
моль/моль; nпс – кількість молів початкової суміші, моль/моль.
Максимальну
температуру вибуху Твиб розраховують за наступних припущень:
ü
горіння протікає при стехіометричній
концентрації α=1;
ü
початкова температура суміші дорівнює 298,15
К;
ü
відбувається адіабатичне горіння суміші при
постійному
об’ємі;
ü
відбувається повне згоряння речовини без
дисоціації продуктів горіння.
Температура
вибуху визначається за методом лінійної інтерполяції, як і температура горіння
при постійному тискові. Відмінність полягає у тому, що при визначенні температури
горіння при постійному тискові обрахунок проводять за тепловмістом продуктів
горіння, а при розрахунку температури вибуху – за внутрішньою енергією
продуктів вибуху:
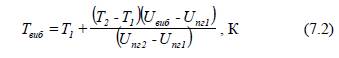
де Т1,
Т2 – температура вибуху в першому та другому
наближенні
відповідно,
К;
Uвиб – внутрішня енергія вибуху суміші, кДж/моль;
Uпг1, Uпг2 – внутрішня енергія продуктів вибуху при
температурі Т1 і Т2 відповідно, кДж/моль/
Температуру
вибуху в першому наближенні Т1,визначають
за значенням середньої енергії продуктів вибуху Uср, орієнтуючись на
внутрішню енергію азоту.Як і при визначенні
температури горіння, температуру вибуху приймають дещо нижчою, ніж за азотом.
Середню
енергію продуктів вибуху визначають за формулою:
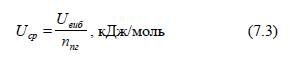
де Uвиб – внутрішня енергія вибуху суміші, кДж/моль,
визначається за формулою:
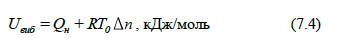
де Qн – нижня теплота
згоряння, кДж/моль;
R – універсальна
газова стала, 8,314×10 –3 кДж/моль×К;
T0 – початкова температура суміші, К;
Δn – різниця між
числом молів продуктів горіння та початкової суміші, моль/моль.
Для
визначення температури вибуху в другому наближенні Т2, необхідно порівняти значення середньої енергії
продуктів вибуху при температурі Т1,
зі значенням енергії вибуху:
ü якщо Uпг1
< Uвиб,
то Т2> Т1,;
ü якщо Uпг1>
Uвиб, то Т2<Т1.
Внутрішню
енергію продуктів вибуху при температурі Т1,іТ2 визначають за формулою:
![]()
де Uпгі1(2) – внутрішня
енергія і-го компонента продуктів згоряння при температурі Т1,іТ2 відповідно, кДж/моль;
nпгі – кількість молів і-го компонента продуктів
згоряння, моль/моль.
Приклад 7.1:
Визначити
максимальний тиск при вибуху парів метилацетату (С3Н6О2),
якщо
початкова температура суміші 20
°С, а
тиск становить 100 кПа. Теплота
утворення метилацетату – ΔН0f = –409,1 кДж/моль.
Вирішення:
1.
Складаємо рівняння реакції горіння метилацетату:
С3Н6О2 + 3,5(О2
+ 3,76N2) = 3×СО2 + 3×Н2О+
3,5×3,76N2.
2.
Визначаємо теоретичне число молів продуктів
горіння: nпгі = 3 + 3 + 3,5×3,76 = 19,16 моль/моль.
3.
Визначаємо теоретичне число молів початкової
суміші: nпс
= 1 + 3,5×4,76 =
17,66 моль/моль.
4.
Визначаємо нижчу теплоту згоряння метилацетату:
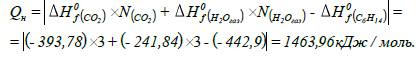
5.
Визначаємо різницю між числом молів продуктів
горіння та початкової суміші: D n = nпгі - nпс
= 19,16 – 17,66 = 1,5 моль/моль.
6.
Визначаємо внутрішню енергію вибуху горючої
суміші:
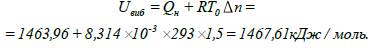
7.
Визначаємо середню енергію продуктів вибуху.
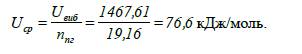
8.
Орієнтуючись на внутрішню енергію нітрогену,
визначаємо температуру вибуху у першому наближенні: Т1, = 3000 К.
9.
Визначаємо внутрішню енергію вибуху при
температурі вибуху Т1:
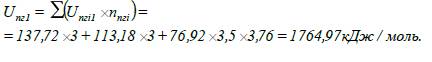
10.
Визначаємо температуру вибуху у другому
наближенні Т2. Враховуючи
те, що внутрішня енергія продуктів вибуху при температурі Т1 виявилася більшою за енергію початкової суміші, то температура
Т2 повинна бути меншою за Т1. Отже:
Т2 = 2800
К.
11.
Визначаємо внутрішню енергію продуктів вибуху
при температурі Т2:
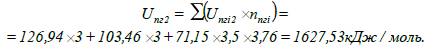
12.
Визначаємо температуру вибуху за допомогою
методу лінійної інтерполяції:
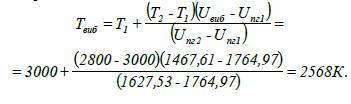
13.
Визначаємо максимальний тиск вибуху метилацетату:
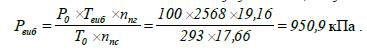
Відповідь: максимальний
тиск вибуху парів метилацетату при початковій
температурі суміші 20 °С та тискові 100 кПа становить 950,9 кПа.

