ЛУЖНІ АКУМУЛЯТОРИ
Найпоширенішими
аккумуляторами з лужним електролітом є залізо-нікелеві, кадмій-нікелеві, та
срібно-цинкові.
Електроліт –
розчин калій гідроксиду концентрації 20-30% ![]() з добавкою
з добавкою ![]() .
.
Залізо-нікелеві та
кадмій-нікелеві акумулятори мають додатній електрод з
гідроксиду нікелю, а від’ємний – відповідно з заліза чи кадмію.
При
роботі на електродах йдуть такі процеси:
A: ![]()
K: ![]()
Схематично
сумарні реакції можна виразити рівняннями:
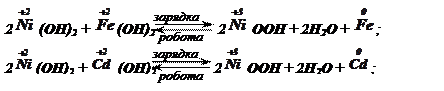
РС=1,48 В;
ЕРС=1,45
В.
Перевагами
залізо-нікелевих та кадмій-нікелевих акумуляторів є великий термін служби (до
10 років) і висока механічна міцність. Недоліки – невисокі ККД (60-65%) і електрорушійна
сила.
Кадмій-нікелеві
акумулятори використовуються для
живлення апаратури зв’язку, радіоприймачів, різної електронної апаратури, а
залізо-нікелеві для живлення електрокарів, навантажувачів.
Срібно-цинкові
акумулятори мають добрі електричні характеристики, малу
масу і об’єм. Електродами є оксиди срібла ![]() ,
, ![]() і губчатий цинк. Електроліт –
і губчатий цинк. Електроліт – ![]() .
.
Сумарну
реакцію при роботі можна виразити рівнянням:
![]() ; ЕРС ≈1,85 В.
; ЕРС ≈1,85 В.
Питома
енергія цього акумулятора відносно велика – 60…100 Вт∙год/кг, проте він дорогий
і має малий термін служби, тому використовується обмежено – в основному у
реактивній авіації та в космічній техніці.
У зв’язку з
забрудненням навколишнього середовища викидами автомобільних двигунів
внутрішнього згорання створюються моделі електромобілів, які працюють на
акумуляторах. Наприклад, недорогий нікель-цинковий акумулятор з питомою
енергією ~ 50 Вт∙год/кг забезпечує пробіг автомобілем без зарядки 100…150
км. Сірчано-натрієвий акумулятор з твердим електролітом має питому енергію 100…200
Вт∙год/кг. Проте найрадикальнішим вирішенням проблеми захисту
навколишнього середовища є нові методи прямого перетворення хімічної енергії
палива в електричну, яке здійснюється у паливних елементах. Попередньо викопне
паливо перетворюють у газ з високим вмістом водню (відновник), який на аноді
окислюється. Окисником може бути кисень, який відновлюється на катоді.
Схема процессу:
![]() .
.
Ще
перспективнішою є воднева енергетика. Запаси водню величезні, він легко вступає
у хімічні реакції, виділяючи величезну кількість енергії. Проте процеси
одержання водню з сполук є енергозатратними, а його зберігання через високу
хімічну активність і малу питому вагу створює ряд проблем.

