ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ
Дія будь-якого гальванічного елемента
ґрунтується на окисно-відновній реакції, окисний і відновний процеси якої
розділені.
Якщо скласти
електрохімічне коло з двох електродів,
сполучити електроди провідником і забезпечити перехід іонів між
електролітами, то в одержаній системі буде здійснено напрямлений рух електронів
за рахунок різниці потенціалів електродів. Від електрода з меншим значенням
потенціалу (анод, від’ємний полюс) електрони переміщаються до електрода
з більшим значенням потенціалу (катод, додатній полюс). У системі
виникає електричний струм. При цьому на аноді іде процес окиснення,
на катоді – відновлення. Такий прилад називається гальванічним
елементом.
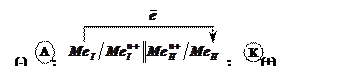 Наприклад, гальванічний елемент складений з двох
металевих електродів
Наприклад, гальванічний елемент складений з двох
металевих електродів ![]() і
і ![]() .
Схема гальванічного елемента:
.
Схема гальванічного елемента:
Анодом у
гальванічному елементі є електрод з меншим значенням потенціалу: ![]() . За рахунок різниці потенціалів електрони
спрямовуються від анода до катода.
. За рахунок різниці потенціалів електрони
спрямовуються від анода до катода.
Процеси на
електродах:
на аноді - A: ![]() – окиснення;
– окиснення;
на катоді -
K: ![]() – відновлення.
– відновлення.
Сумарне рівняння: ![]() .
.
Електрорушійна сила гальванічного елемента (ЕРС,В) рівна різниці потенціалів катода і анода:
![]()
Якщо
умови роботи гальванічного елемента стандартні, то використовують стандартні
електродні потенціали з таблиць, у інших випадках – рівноважні потенціали,
розраховані за рівнянням Нернста.
Величина
електрорушійної сили через максимальну корисну роботу гальванічного елемента
пов’язана з енергією Гіббса (![]() )
реакції, яка відбувається у гальванічному елементі:
)
реакції, яка відбувається у гальванічному елементі:
![]() ,
,
![]() – число електронів;
– число електронів;
![]() – стала Фарадея;
– стала Фарадея;
![]() .
.
Сумарний
окисно-відновний процес, який забезпечує роботу гальванічного елемента, іде
самочинно в напрямку зменшення енергії Гіббса: ![]() ;
відповідно
;
відповідно ![]() .
.
Отже, для роботи гальванічного елемента може бути використана лише така
окисно-відновна хімічна реакція, яка відбувається самочинно.

