Лабораторне
заняття
Тема:
ЕЛЕКТРОХІМІЧНІ
ПРОЦЕСИ. ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ
Мета
заняття: вивчити електрохімічні процеси, що
відбуваються при роботі гальванічних елементів. Навчитись складати схеми
гальванічних елементів, визначати анод, катод, обчислювати електрорушійну силу
гальванічного елемента.
ПИТАННЯ
ДЛЯ ПІДГОТОВКИ
1. Електродний потенціал.
2. Ряд напруг металів.
3. Будова гальванічного елемента.
4. Електрорушійна сила гальванічного елемента.
5. Рівняння Нернста.
ТЕОРЕТИЧНІ
ВІДОМОСТІ
На межі «метал / розчин електроліту» за
рахунок виходу іонів з розчину на металі завжди утворюється подвійний
електричний шар. Система метал / розчин електроліту називається
електродом, а потенціал, який встановлюється на електроді при зрівноваженні
прямого і зворотного процесів, називається рівноважним електродним потенціалом
металу (![]() ). Величина рівноважного електродного потенціалу
залежить від природи металу, концентрації його іонів у розчині і від
температури.
). Величина рівноважного електродного потенціалу
залежить від природи металу, концентрації його іонів у розчині і від
температури.
Стандартним електродним потенціалом
металу ![]() називають рівноважний
електродний потенціал, який виникає при зануренні металу в розчин його солі з
концентрацією
називають рівноважний
електродний потенціал, який виникає при зануренні металу в розчин його солі з
концентрацією ![]() , виміряний у порівнянні з стандартним водневим електродом
при 298 К.
, виміряний у порівнянні з стандартним водневим електродом
при 298 К.
Якщо метали розташувати в ряд за величинами
стандартних електродних потенціалів у порядку їх зростання, то одержимо електрохімічний
ряд напруг металів (додаток 3). Тому, що
значення потенціалу характеризує окисно-відновні властивості системи Men+/Me, місце металу
в ряду напруг визначає його хімічну відновну активність у водних розчинах.
Більш активним відновником є той метал, потенціал якого менший, тобто той, що
розташований ближче до початку ряду напруг.
За умов, що
відрізняються від стандартних, величина рівноважного потенціалу металу
визначається за рівнянням Нернста, що є спрощеним загальним рівнянням
електродного потенціалу:
![]() ,
,
![]() - стандартний
електродний потенціал металу, В;
- стандартний
електродний потенціал металу, В;
![]() - число відданих чи приєднаних електронів;
- число відданих чи приєднаних електронів;
![]() - концентрація іонів
металу в розчині солі, моль/л.
- концентрація іонів
металу в розчині солі, моль/л.
Якщо
скласти електрохімічне коло з двох електродів,
сполучити електроди провідником і забезпечити перехід іонів між електролітами,
то в одержаній системі буде здійснено напрямлений рух електронів за рахунок
різниці потенціалів електродів. Від
електрода з меншим значенням потенціалу (анод, від’ємний полюс)
електрони переміщаються до електрода з більшим значенням потенціалу (катод,
додатній полюс). У системі виникає електричний струм. При цьому на аноді
іде процес окиснення, на катоді – відновлення. Такий прилад
називається гальванічним елементом. Гальванічний елемент – це пристрій, в якому хімічна
енергія самодовільної окисно-відновної реакції перетворюється в електричну.
Електрорушійна сила гальванічного елемента (ЕРС,В) рівна різниці потенціалів катода і анода:
![]() .
.
Мідно-цинковий
гальванічний елемент
Електродами є
цинкова і мідна пластини у розчинах їх сульфатів.
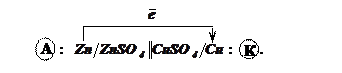 Схема гальванічного елемента:
Схема гальванічного елемента:
Процеси на
електродах:
A:
![]() ;
;
K:
![]() .
.
Струмоутворююча
реакція:
![]() (іонне рівняння);
(іонне рівняння);
![]() (молекулярне
рівняння).
(молекулярне
рівняння).
Концентраційний
гальванічний елемент
При різних
концентраціях електролітів можна одержати різницю потенціалів між електродами з
одного металу. На цьому принципі працюють концентраційні гальванічні
елементи.
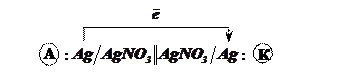 Схема гальванічного елемента:
Схема гальванічного елемента:
С1 < С2
A:
![]()
K:
![]() .
.
Струмоутворююча
реакція:
![]() (іонне рівняння);
(іонне рівняння);
![]() (молекулярне рівняння).
(молекулярне рівняння).
ЕКСПЕРИМЕНТАЛЬНА
ЧАСТИНА
Дослід
1. Дослідження активності металів
Налити в окремі пробірки по 15-20 крапель розчину солей
цинку, нікелю, олова, свинцю, міді. Опустити в них на 1-2 хв. однакові кусочки
цинку або заліза. Що спостерігається? Написати рівняння реакцій.
Аналогічно виконати дослід з свинцем чи оловом.
Із яких розчинів свинець чи олово витісняють метали?
Спостереження записати в
таблицю, ставлячи знак «плюс» в тих випадках, коли дані метали витіснялись із
солей, або знак «мінус», коли витіснення не відбулось.
|
Занурений метал |
Іони металу в розчині |
||||
|
Zn2+ : |
Ni2+ : |
Sn2+: |
Pb2+: |
Cu2+: |
|
|
|
|
|
|
|
|
|
Цинк |
|
|
|
|
|
|
Залізо |
|
|
|
|
|
|
Свинець |
|
|
|
|
|
Досліджувані метали розташувати в
ряд по зменшенню їх відновлювальної здатності, записати їх нормальні електродні
потенціали.
Дослід
2. Гальванічний елемент Даніеля-Якобі
Налити в одну кювету ![]() в другий –
в другий – ![]() . Опустити в ці розчини відповідно цинкову та
мідну пластинки з приєднаними до них провідниками. З’єднати розчини
електролітичним містком, заповненим гелем з розчину калій хлориду, а провідники
під’єднати до вольтметра. Заміряти ЕРС складеного гальванічного елемента.
Замінити в цинковому півелементі 1М розчин
. Опустити в ці розчини відповідно цинкову та
мідну пластинки з приєднаними до них провідниками. З’єднати розчини
електролітичним містком, заповненим гелем з розчину калій хлориду, а провідники
під’єднати до вольтметра. Заміряти ЕРС складеного гальванічного елемента.
Замінити в цинковому півелементі 1М розчин
![]() на
на ![]() і після
двох хвилин роботи гальванічного елемента заміряти ЕРС.
і після
двох хвилин роботи гальванічного елемента заміряти ЕРС.
Повторити вимірювання ЕРС, послідовно замінюючи 1М
розчин ![]() в мідному
півелементі на 0,01М розчин
в мідному
півелементі на 0,01М розчин ![]() , а далі
, а далі ![]() на 1М розчин
на 1М розчин ![]() .
.
Записати схему
складеного гальванічного елемента та електрохімічні рівняння процесів, що
протікають біля електродів при роботі гальванічного елемента. Вказати, який з
електродів є анодом, який – катодом.
Виписати значення нормальних електродних потенціалів міді
і цинку (додаток 3), обчислити теоретичні значення ЕРС складених гальванічних
елементів і порівняти їх з одержаними експериментально.
Одержані дані записати в
таблицю:
|
Молярна
концентрація моль/л |
Експеримент ЕРС, В: |
Теоретична, ЕРС, В: |
Відносна похибка, % |
|
|
|
|
|||
|
1,00 |
1,00 |
|
|
|
|
0,01 |
1,00 |
|
|
|
|
0,01 |
0,01 |
|
|
|
|
1,00 |
0,01 |
|
|
|
ПРИКЛАДИ
РОЗВ’ЯЗУВАННЯ ЗАДАЧ
1. Дві залізні пластинки опустили в
пробірки з розчинами ![]() і
і ![]() . В якій пробірці відбудеться реакція?
. В якій пробірці відбудеться реакція?
Розв’язання.
За даними таблиці стандартних електродних потенціалів потенціал (додаток 3) заліза більший за
алгебраїчною величиною, ніж потенціал цинку:
j0 (Fe
2+/ Fe) =
-0,44 В;
j0 (Zn 2+
/ Zn) = -0,76 В.
Отже,
залізо менш активне, ніж цинк,
і не може витіснити його з солі. Реакція заліза з ZnSO4 не
відбудеться.
Оскільки
значення j0
Fe
2+/ Fe (-0,44 В) менше, ніж j0
Cu2+/Cu
(+0,34 В), то залізо, як більш
активний метал витіснить мідь з її солі. Залізо буде реагувати з розчином купрум сульфату:
Fe + CuSO4 = Cu + FeSO4.
Електронні
рівняння:
Fe - 2e ® Fe2+
(окиснення, Fe –
відновник);
Cu2+
+ 2е ®
Cu 0 (відновлення, Cu2+ - окисник).
2.
Магнієву пластинку опустили в розчин
солі Mg2+.
При цьому рівноважний потенціал магнію виявився рівним –2,41 В. Обчислити
концентрацію іонів Mg2+ (моль/л).
Розв’язання.
За рівнянням Нернста
![]() ;
;
![]() ;
; ![]() ;
;
![]() ;
; ![]()
![]()
![]()
![]()
![]()
3.
Скласти схему гальванічного елемента, в якому електродами є магнієва і цинкова
пластинки, опущені в розчини їх солей з концентрацією іонів по 1 моль/л.
Записати рівняння процесів на електродах, рівняння окисно-відновної реакції, що
відбувається в цьому гальванічному елементі, і вирахувати його електрорушійну
силу.
Розв’язання.
Схема гальванічного елемента:
ē
![]() (- A) Mg ½ Mg2+ ½½ Zn 2+ ½ Zn (К+)
(- A) Mg ½ Mg2+ ½½ Zn 2+ ½ Zn (К+)
j0 Mg2+/Mg = -2,37 B; j0 Zn2+/Zn = - 0,763 B.
Анод
– магнієвий електрод, бо його потенціал менший, ніж цинку.
На
аноді відбувається процес окиснення:
Mg – 2ē ®
Мg2+.
Катод
– цинковий електрод, на катоді – процес відновлення:
Zn2+
+ 2ē ® Zn0.
Додавши рівняння електродних процесів почленно, одержимо
рівняння окисно-відновної реакції, яка
забезпечує роботу цього гальванічного елемента:
в іонному вигляді:
Mg
+ Zn2+ = Mg 2+ + Zn
потенціали електродів мають стандартні
значення, бо концентрації іонів становлять по 1 моль/л. Тому електрорушійна
сила елемента рівна різниці стандартних потенціалів його електродів:
Е
= j0
(Zn 2+/Zn)
- j0(
Mg2+/Mg)
= -0,763 - (- 2,37) = 1,607 В.
ЗАДАЧІ
ТА ВПРАВИ
1.
Скласти схеми двох гальванічних елементів, в
одному з яких залізо є катодом, в другому – анодом. Написати рівняння реакції,
які відбуваються на електродах.
2.
Скласти схему гальванічного елемента, в якому
нікель окиснюється. Написати рівняння реакції, які відбуваються на електродах.
3.
Скласти схему гальванічного елемента, в якому
відбувається відновлення срібла. Написати рівняння реакції, які відбуваються на
електродах.
4.
Розрахувати стандартну ЕРС елемента, в якому
іде реакція за рівнянням:
![]() .
.
5.
Марганцевий електрод в розчині його солі має
потенціал -1,23 В. Обчислити концентрацію іонів Mn2+
(моль/л).
6. Скласти схему, написати рівняння електродних процесів і
сумарну хімічну реакцію гальванічного елемента, у якого один електрод кадмієвий
з концентрацією іонів Cd2+ 1·10–1 моль/л, а другий — мідний з такою ж концентрацією іонів Cu2+. Розрахувати
електрорушійну силу цього елемента.
7. Скласти
схему і написати рівняння електродних процесів гальванічного елемента,
складеного з срібної і свинцевої пластин, опущених в розчини їхніх солей з
концентрацією СAg+= CPb2+
= 1,0 моль/л. Розрахувати електрорушійну силу цього елемента. Чи зміниться
вона, якщо концентрації іонів зменшити в 10 раз? Підтвердити розрахунком.
8. У
якого з гальванічних елементів стандартна електрорушійна сила буде більшою:
Fe ê Fe 2+ êê Cu 2+ ê Cu, чи Zn ê Zn2+
êê Hg2+ ê Hg?
Підтвердити обчисленнями.

