Тема:
ВИЗНАЧЕННЯ ЕКВІВАЛЕНТНОЇ МАСИ МЕТАЛУ
Мета заняття: ознайомитись
з експериментальним методом визначення еквівалентної маси металу шляхом
витіснення водню.
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Що таке «еквівалент» та «еквівалентна маса»?
2. Сформулювати закон еквівалентів, записати математичний
вираз закону.
3. Як обчислюються еквівалент та еквівалентна маса оксидів,
основ, кислот, солей?
ТЕОРЕТИЧНІ ВІДОМОСТІ
Еквівалент речовини (![]() ) - це така кількість речовини, яка сполучається з 1 молем
атомів Гідрогену або заміщає таку його кількість в хімічних реакціях.
) - це така кількість речовини, яка сполучається з 1 молем
атомів Гідрогену або заміщає таку його кількість в хімічних реакціях.
Маса
одного моля еквівалентів речовини називається його еквівалентною масою (![]() ). Еквіваленти виражаються в молях, а еквівалентні маси – в [г/моль-екв].
). Еквіваленти виражаються в молях, а еквівалентні маси – в [г/моль-екв].
Згідно закону еквівалентів маси (об’єми) реагуючих
речовин пропорційні їх еквівалентним масам (об’ємам):
![]()
Теоретично еквівалентну масу простої речовини визначають
за формулою:
![]() .
.
Наприклад, еквівалентна маса магнію
![]() .
.
Визначення
еквівалентних мас
1) Проста речовина
![]() [г/моль-екв],
[г/моль-екв],
де ![]() – молярна атомна маса;
– молярна атомна маса;
![]() – валентність елемента.
– валентність елемента.
Наприклад:
![]() [г/моль-екв],
[г/моль-екв],
![]() [г/моль-екв].
[г/моль-екв].
2) Оксид ЕхОу
![]() [г/моль-екв],
[г/моль-екв],
де ![]() – молярна маса оксиду,
г/моль;
– молярна маса оксиду,
г/моль;
![]() – валентність
елемента, який утворює оксид;
– валентність
елемента, який утворює оксид;
![]() – кількість атомів
цього елемента.
– кількість атомів
цього елемента.
Або:
![]() .
.
Наприклад:
![]() (г/моль-екв).
(г/моль-екв).
3) Кислота НхЕОу
![]() [г/моль-екв],
[г/моль-екв],
де основність – число атомів Гідрогену,
що заміщуються у реакції (Враховувати при
утворенні кислих солей, так при взаємодії Н3PO4 з NaOH, на Na, в залежності від кількості NaOH, може заміщуватись
один атом водню з утворенням NaH2PO4; два атоми водню з
утворенням Na2HPO4, три атоми водню з
утворенням Na3PO4. У першому випадку
основність Н3PO4 складатиме один, у
другому – 2, у третьому – три).
![]() – молярна маса
кислоти, г/моль.
– молярна маса
кислоти, г/моль.
Або:
![]() .
.
Наприклад:
![]() (г/моль-екв)
(г/моль-екв)
4) Основа Е(ОН)х
![]() [г/моль-екв],
[г/моль-екв],
де кислотність – число груп ОН–,
що заміщуються у реакції (враховувати при утворенні основних солей);
![]() – молярна маса основи,
г/моль.
– молярна маса основи,
г/моль.
Або:
![]() Наприклад:
Наприклад:
![]() (г/моль-екв).
(г/моль-екв).
5) Сіль
![]() [г/моль-екв]
[г/моль-екв]
або:
![]() ,
,
де ![]() – валентність металу,
– валентність металу,
![]() – кількість атомів
металу,
– кількість атомів
металу,
![]() – молярна маса солі, г/моль.
– молярна маса солі, г/моль.
Наприклад:
![]() (г/моль-екв).
(г/моль-екв).
Теоретично еквівалентний
об’єм газу
простої речовини визначають за формулою:
![]() ,
,
Де Vm –
молярний об’єм газу за н.у. (22,4
л/моль),
в - валентність елемента,
![]() – кількість атомів
елемента у молекулі газу.
– кількість атомів
елемента у молекулі газу.
Наприклад:
![]() (л/моль-екв).
(л/моль-екв).
Експериментально для визначення еквівалентної маси металу необхідно
наважку цього металу ввести в реакцію з надлишком кислоти. При цьому виділиться
еквівалентна кількість водню.
Еквівалентну масу металу розрахуємо за законом
еквівалентів:
![]()
де ![]() – маса металу, г;
– маса металу, г;
![]() – об’єм
водню, що виділився, приведений до нормальних умов, мл;
– об’єм
водню, що виділився, приведений до нормальних умов, мл;
![]() – еквівалентна маса металу, г/моль-екв.;
– еквівалентна маса металу, г/моль-екв.;
![]() – еквівалентний об’єм водню, л/моль-екв.
– еквівалентний об’єм водню, л/моль-екв.
За нормальних умов
![]() .
.
Об’єм водню, що
виділиться при реакції, визначають експериментальним шляхом. Для цього водень
треба зібрати в мірному циліндрі шляхом витіснення води.
Таблиця 1.
Тиск насиченої
водяної пари в залежності від температури
|
Температура оС |
Тиск |
Температура оС |
Тиск |
|||
|
кПа |
мм.рт.ст. |
кПа |
мм.рт.ст. |
|||
|
13 |
1,49 |
11,2 |
22 |
2,64 |
19,8 |
|
|
14 |
1,53 |
11,9 |
23 |
2,81 |
21,1 |
|
|
15 |
1,68 |
12,6 |
24 |
2,99 |
22,4 |
|
|
16 |
1,81 |
13,6 |
25 |
3,17 |
23,8 |
|
|
17 |
1,93 |
14,5 |
26 |
3,36 |
25,2 |
|
|
18 |
2,07 |
15,5 |
27 |
3,56 |
26,7 |
|
|
19 |
2,20 |
16,5 |
28 |
3,75 |
28,1 |
|
|
20 |
2,33 |
17,3 |
29 |
3,97 |
29,8 |
|
|
21 |
2,49 |
18,7 |
30 |
4,21 |
31,6 |
|
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
Необхідні прилади та реактиви:
плоскодонна колба з газовідвідною трубкою, штатив Бунзена з затискачами,
кристалізатор, мірний циліндр, термометр, барометр, торзійні терези, магній
(порошок), хлоридна кислота.
ВИКОНАННЯ ДОСЛІДУ
1. Скласти прилад зображений на рис. 1
2. Зважити порошок магнію (близько ![]() ) на торзійних терезах. Загорнути наважку в фільтрувальний
папір.
) на торзійних терезах. Загорнути наважку в фільтрувальний
папір.
3. Заповнити кристалізатор водопровідною водою приблизно на
2/3 об’єму.
4. Повністю заповнити циліндр водою і помістити його в
кристалізатор отвором вниз так, щоб в циліндрі не було бульбашок повітря. Для
цього циліндр з водою накрити шматочком фільтрувального паперу і папір
притиснути лівою рукою, при цьому циліндр взяти в праву руку. Швидко
перевернути циліндр, помістити у воду, і якщо повітря не попало в циліндр,
закріпити його в штативі.
5. В колбу налити ![]() розчину хлоридної
кислоти, тримаючи колбу в горизонтальному положенні. В горло колби помістити
фільтрувальний папір з наважкою магнію.
розчину хлоридної
кислоти, тримаючи колбу в горизонтальному положенні. В горло колби помістити
фільтрувальний папір з наважкою магнію.
6. Закрити отвір колби корком з газовідвідною трубкою.
Кінець трубки ввести під водою в отвір циліндра.
7. Повернути колбу у вертикальне положення, щоб наважка
магнію попала в кислоту. Спостерігати виділення газу, який збирається у верхній
частині циліндра, витісняючи воду.
8. Після завершення реакції результати подати у вигляді таблиці.
9. Прилад розібрати і привести в порядок робоче місце.
10.
Обчислити еквівалентну
масу магнію і помилку експерименту.
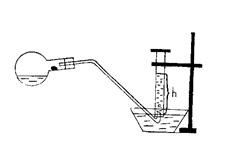
Рис. 1 –
Прилад для визначення еквівалентної маси металу
Результати досліду
|
№ п/п |
Параметри досліду |
Умовне позначення |
Одиниці вимірів |
Числове значення |
|
1. |
Маса магнію |
m(Mg) |
г |
|
|
2. |
Об’єм водню, що виділився |
V(H2) |
мл. |
|
|
3. |
Висота стовпа води в циліндрі від поверхні води в
кристалізаторі до поверхні води в циліндрі |
h |
мм |
|
|
4. |
Атмосферний тиск в лабораторії |
Pатм |
мм.рт.ст. |
|
|
5. |
Пружність водяної пари при температурі досліду (табл.
1) |
P(H2O) |
мм.рт.ст. |
|
|
6. |
Температура в приміщені |
T |
К |
|
|
7. |
Температура за н.у. |
T0 |
К |
273 |
|
8. |
Тиск за н.у. |
P0 |
мм.рт.ст. |
760 |
|
9. |
Еквівалентний об’єм водню за н.у. |
V0E(H2) |
мл моль.екв. |
11200 |
РОЗРАХУНКИ
1. Обчислити тиск водню в циліндрі:
![]() ,
,
де ![]() – парціальний тиск
водню в циліндрі, мм.рт.ст.;
– парціальний тиск
водню в циліндрі, мм.рт.ст.;
![]() – тиск в лабораторії, мм.рт.ст.;
– тиск в лабораторії, мм.рт.ст.;
![]() – насичений тиск
водяної пари /залежить від температури і визначається по таблиці , мм.рт.ст;
– насичений тиск
водяної пари /залежить від температури і визначається по таблиці , мм.рт.ст;
![]() – тиск стовпа води в циліндрі, мм.рт.ст;
– тиск стовпа води в циліндрі, мм.рт.ст;
![]() – висота стовпа води, мм;
– висота стовпа води, мм;
![]() – густина ртуті.
– густина ртуті.
2. Привести об’єм водню, що виділився, до нормальних
умов:
![]() ,
,
![]() .
.
3. Розрахувати еквівалентну масу магнію:
![]() .
.
4. Обчислити абсолютну і відносну помилку експерименту:
![]()
![]() .
.
ЗАДАЧІ ТА ВПРАВИ
1. З
![]() г гідроксиду металу
можна одержати
г гідроксиду металу
можна одержати ![]() його броміду.
Визначити еквівалентну масу металу. Сформулювати закон, за яким виконуються
подібні задачі.
його броміду.
Визначити еквівалентну масу металу. Сформулювати закон, за яким виконуються
подібні задачі.
2. Для
відновлення ![]() оксиду металу потрібно стільки ж водню, скільки його
виділяється при реакції
оксиду металу потрібно стільки ж водню, скільки його
виділяється при реакції ![]() цинку з кислотою.
Визначити еквівалентну масу оксиду металу та еквівалентну масу металу.
цинку з кислотою.
Визначити еквівалентну масу оксиду металу та еквівалентну масу металу.
3. З
![]() нітрату металу
одержано
нітрату металу
одержано ![]() його гідроксиду.
Визначити еквівалентну масу металу.
його гідроксиду.
Визначити еквівалентну масу металу.
4. Обчислити еквівалент і еквівалентну масу ортофосфатної кислоти в реакціях
утворення гідрофосфатів та фосфату натрію. Записати відповідні реакції.
5. Обчислити
еквівалент і еквівалентну масу сульфатної
кислоти в реакціях утворення гідросульфату
та сульфату натрію. Записати відповідні реакції.
6. Чому
дорівнює при н.у. еквівалентний об’єм кисню? На спалювання ![]() двовалентного металу
витрачено
двовалентного металу
витрачено ![]()
![]() (н.у.). Обчислити
еквівалентну масу металу та його атомну масу.
(н.у.). Обчислити
еквівалентну масу металу та його атомну масу.
7. На
нейтралізацію ![]() гіпофосфітної кислоти Н3РО2
витрачено
гіпофосфітної кислоти Н3РО2
витрачено ![]() NаОН. Обчислити
еквівалентну масу, основність кислоти і записати рівняння реакції
нейтралізації.
NаОН. Обчислити
еквівалентну масу, основність кислоти і записати рівняння реакції
нейтралізації.
8. На
нейтралізацію ![]() фосфітної кислоти Н3РО3
витрачено
фосфітної кислоти Н3РО3
витрачено ![]() КОН. Обчислити
еквівалентну масу, еквівалент та основність кислоти і записати рівняння реакції
нейтралізації.
КОН. Обчислити
еквівалентну масу, еквівалент та основність кислоти і записати рівняння реакції
нейтралізації.
9. На
реакцію з ![]() солі витрачено
солі витрачено ![]() NаОН. Обчислити
еквівалентну масу солі в цій реакції. Сформулювати закон, використаний при
обчисленні.
NаОН. Обчислити
еквівалентну масу солі в цій реакції. Сформулювати закон, використаний при
обчисленні.
Чи є еквівалент елемента постійною
величиною? Чому дорівнює еквівалент та еквівалентна маса хрому в його оксидах,
що містять ![]() ,
, ![]() і
і ![]() хрому. Визначити
валентність хрому в кожному з цих оксидів і скласти їх формули.
хрому. Визначити
валентність хрому в кожному з цих оксидів і скласти їх формули.

