Арени. Бензен: молекулярна і структурна формули, фізичні властивості. Хімічні властивості
бензену. Методи одержання, бензену. Застосування вуглеводнів.
На
початку другої половини XIX
ст. ароматичними називали речовини, які мали
приємний запах або були виділені з
природних духмяних речовин – рослинних смол, бальзамів, ефірних масел. Пізніше було встановлено,
що більшість речовин, які належали до цієї групи, не мали ароматичного запаху. Проте історична назва їх збереглась.
Тепер до ароматичних вуглеводнів
належать речовини, в молекулах яких
є стійке циклічне угрупування атомів з особливим
характером зв’язку – ядро бензену.
Міжнародна назва ароматичних вуглеводнів – арени.
Найпростішим представником аренів
є бензен С6Н6.
1. Історія відкриття бензену.
Вперше бензен описав німецький
хімік Іоннан Глаубер у 1649 році. Він отримав бензен
в результаті перегонки кам’яно–вугільної смоли. Але вчений не
дав назви, бо не міг пояснити будову.
Друге
своє народження бензен отримав завдяки працям англійського вченого Майкла Фарадея
у 1825 році, який добув бензен із
рідкого конденсату світильного
газу, що використовували у вуличних ліхтарях. На початку
20ст. В Лондоні для освітлення
вулиць у ліхтарях стали використовувати світильний газ. Його одержували шляхомсухої перегонки кам’яного вугілля й зберігали
під тиском у залізних балонах. Місцеві жителі були незадоволені його освітленням. В. Скоттписав: «світ перевернувся, Лондон буде освітлюватись
вугільним димом». Виробники свічок відкрито трощили нові фонорі. Сам же світильний газ втрачав свою горючість з часом і виділялось багато
кіптяви. У 1825 р. За допомогою
до М. Фарадея звернулись власники
газового заводу. Він з’ясував,
що з часом на дні балонів утворюється
осад у вигляді маслянистої рідини і виділивши
його відкрив невідомий раніше вуглеводень. Також встановив, що дана речовина складається лише з двох
атомів – Карбону і Гідрогену – СН.
У
1833 – 1835рр. німецький хімік
Е.Митчерлик досліджував цю речовину, визначив
його формулу і назвав бензином (від арабського слова «ті що приємно пахнуть»). Ю. Лібіх і ряд вчених
хіміків виступали проти, говорячи що суфікс –ин вказує на присутність
атомів Нітрогену в молекулі, а це не так. Ними була запропонована назва бензол,
суфікс –ол вказував на маслянистість речовини. Проте суфікс –ол вказував на
приналежність сполуки до класу спиртів і
наявність гідроксильної групи. Суперечки точились довгий час, в результаті речовина С6Н6, формула на той час була вже уточнена, отримала назву бензен, суфікс –ен вказував на наявність подвійного звязку. В українській номенклатурі
прижилась назва бензол і лише порівняно недавно змінилась на бензен.
2. Будова і склад молекули
бензену.
Протягом сорока років між
хіміками були уточнення, щодо властивостей і будови бензену.
Властивості бензену,
виявлені хіміками, не
давали змоги однозначно описати
будову його молекули. Атомів Гідрогену в молекулі бензену С6Н6 значно
менше, ніж у молекулі насиченого вуглеводню гексану С6Н14.
Це вказувало на наявність у молекулі бензену подвійних або навіть потрійних
зв’язків (тобто бензен мав бути ненасиченим вуглеводнем). Однак сполука виявилася
хімічно
пасивною (як і насичені вуглеводні), на відміну від алкенів
і алкінів не знебарвлювала бромної води, розчину калій перманганату. Щоправда, за особливих умов
молекула С6Н6 усе ж приєднувала
три молекули водню або хлору. Також було з’ясовано, що похідні бензену
з одним атомом галогену в молекулах не мали ізомерів (у разі відкритого карбонового ланцюга існування ізомерів є очевидним).
Це свідчило про рівноцінність розміщення атомів Карбону в молекулі С6Н6,
що можливо лише при їх сполученні
в замкнений ланцюг. Ураховуючи сукупність виявлених фактів, учені запропонували кілька структурних формул молекули бензену. Із більшістю фактів
найкраще узгоджувалася
формула німецького хіміка
Ф. А. Кекуле:
СН
// \
НС СН
| ||
НС СН
\\ /
СН
В
1865 році А. Кекуле довів, що подвійні
зв’язки не закріплені у молекулі, а постійно переміщуються від одного атома
Карбону до іншого. Молекула бензену
являє собою плоский правильний
шестичленний цикл, в якому всі шість атомів
карбону і шість атомів гідрогену розміщені в одній площині і утворюють
правильний шестикутник з кутом 120°.
Але таке зображення не передає справжньої будови молекули, яка була встановлена пізніше. Подальше дослідження підтвердило наявність бензенового кільця.
Насправді карбон-карбонові зв’язки у бензені рівноцінні і в молекулі немає ні простих, ні
подвійних зв’язків електронна густина розподілена рівномірно (є спільна П-електоронна хмара).
Найточніше це відображає
структурна формула у вигляді правильного шестикутника з колом усередині.
![]() СН
СН
/ \
НС СН
| |
НС СН
\ /
СН
Гомологічний ряд бензену має
загальну формулу СnH2n-6.
Гомологи бензену можна розглядати як похідні бензену, в якому один або кілька атомів
гідрогену заміщені різними вуглеводневими
радикалами.
Група атомів С6Н5 ‑ називається фенільною.
Наприклад, С6Н5–СН3 – метилбензен (толуол), С6Н4(СН3)2–
диметилбензен (ксилол), С6Н5–С2Н5
– етилбензен.
3. Фізичні властивості
бензену.
Бензен — безбарвна летка
рідина зі своєрідним запахом, легша за воду
(густина 0,88 г/см3). Температура плавлення бензену +5,5 °С, кипіння +80,1 °С. Сполука погано розчиняється у воді, але добре ‑ в органічних розчинниках. Цей вуглеводень розчиняє йод, сірку, білий фосфор, жири, інші органічні речовини. Бензен ‑ одна з найстійкіших органічних сполук; його пара не розкладається до 600
°С.
4. Хімічні властивості.
Бензену властиві реакції заміщення, в процесі
яких зберігається стійке бензольне ядро. Реакції приєднання
для бензену проходять важко. Щоб вони відбулись потрібні особливі умови: підвищення температури і тиску, підбір
каталізатора, світлове опромінювання та ін. Це зумовлено міцністю
бензольного ядра, необхідністю
розриву єдиної П-електоронної
хмари. Хімічні властивості бензену можна записати
у вигляді такої схеми:
Реакція Рівняння
реакції
Повне окиснення (горіння) 2С6Н6 +15О2
→ 12СО2 + 6Н2О
Часткове окиснення Бензен
стійкий проти дії окисників
Заміщення С6Н6
+ Br2 кат.→
С6Н5Br + НBr
бромобензен
За участю іншого каталізатора
всі атоми гідрогену у бензені можна замістити галогеном:
С6Н6 + 6Cl2
кат.→ С6Cl6 + 6НCl
гексахлоробензен
Приєднання С6Н6
+ 3Н2 → С6Н12
циклогексан
С6Н6 + 3Cl2 → С6Н6Cl6
гексахлороциклогексан
Бензену більш притаманні
реакції заміщення, які відбуваються легше, ніж у насичених
вуглеводнів, а реакції приєднання відбуваються важче, ніж у ненасичених
вуглеводнів (потрібні особливі умови: підвищення температури і тиску, підбір
каталізатора, світлове опромінення та ін.). Це зумовлено міцністю
бензенового ядра, необхідністю
розриву єдиної П-електронної
хмари. При горінні бензену виділяється багато кіптяви (значна масова частка карбону в молекулі бензену).
5. Добування. У великих кількостях
бензен добувають з нафти і
кам’яновугільної смоли, що утворюється при коксуванні кам’яного вугілля (нагрівання без доступу повітря).
Бензен також добувають
‑ із циклопарафінів ‑ дегідруванням циклогексану
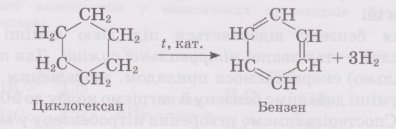
‑ з алканів (гексан) реакцією дегідрування
(відщеплення водню).
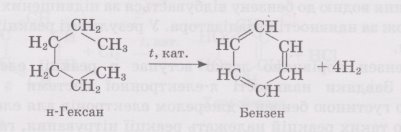
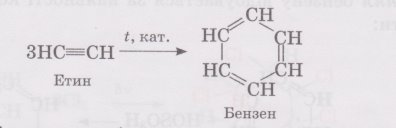
‑ внаслідок полімеризації трьох молекул
ацетилену теж отримують бензен.
6. Застосування. Бензен і його
гомологи застосовуються як хімічна
сировина для виробництва ліків, пластмас, барвників, отрутохімікатів та багатьох інших органічних речовин. Широко використовують їх як розчинники. Бензен як добавка поліпшує якість моторного палива.

