Лекція № 6
ФІЗИКО-ХІМІЧНІ МЕТОДИ ОЧИЩЕННЯ ВОДИ
Фізико-хімічні методи очищення передбачають, як правило, дво- або багатостадійний процеси, на початкових стадіях
яких відбувається попередня підготовка
або перетворення забруднюючих
компонентів стічних вод до їх знешкодження. Основними фізико-хімічними методами є коагуляція,
флотація, сорбція, екстракція, зворотний осмос, мембранні, термічні та
електричні методи.
1. Коагуляція
В значній частині стічних вод основна маса завислих часток
представлені колоїдними частинками. Їх середній розмір складає 10-5
см. Швидкість осадження частинок у воді напряму залежить від їх розміру (маси).
Якщо частинка розміром 10-2
см осідає на глибину 1 м протягом 2 год., то колоїдна частинка – протягом 200
років. Тому для інтенсифікації процесу очищення та видалення із потоку стічних
вод частинок малих розмірів використовують різні методи, які в-першу чергу
направлені на збільшення маси часток шляхом їх укрупнення.
Будова
колоїдної частки
Колоїдні частинки є гідрофобними частками, тобто вони мають
здатність водовідштовхування (у них відсутні гідратні
оболонки). Тому ці частки мають велику поверхневу енергію, в результаті чого на
поверхні частки (ядра) адсорбуються іони певного знаку ( в даному випадку
від’ємні іони) разом із деякою кількістю позитивних іонів-катіонів. Ці іони
тісно зв’язані з поверхнею ядра і разом з ним утворюють гранулу.
В результаті цього гранула набуває певного заряду (-). Навколо
гранули розташовуються позитивні іони, в
результаті чого міцела має нульовий заряд.
Позитивні іони не досить тісно пов’язані із колоїдною часткою,
тому при її русі частина їх відстає ( відривається) від дифузного шару і частинка внаслідок цього набуває певного
заряду (-).
Повне падіння потенціалу на межі тверда речовина – рідина
називають термодинамічним потенціалом. Падіння потенціалу на межі адсорбційного
і дифузійного шарів називають електронно-кінетичним потенціалом. Заряд частинки визначається
електронно-кінетичним потенціалом.
Взаємодія
колоїдних частинок
Так як колоїдні частки заряджені однойменно, то між ними діють
сили відштовхування. Тому така система є агрегатно стійкою: частинки не можуть
підійти достатньо близько одна до одної і злипнутись в більш крупні агрегати
(на дуже малих відстанях діють сили взаємного протягування – сили Ван-дер-Ваальса).
Для того, щоб частинки могли підійти достатньо близько одна до
другої, необхідно знизити від’ємний заряд частини (електронно-кінетичний потенціал) протягування.
Суть
коагулювання води
Для зниження від’ємного заряду колоїдних часток у воду вводять
позитивні іони (катіони) у вигляді хімічних реагентів – коагулянтів. Найбільш
доцільно у воду вводити багатозарядні іони -
Al3+, Mg2+ тощо.
В результаті зниження заряду часток ( навіть до „0”) частки
мають властивість легко злипатись в крупні агрегати, які досить швидко осідають
і можуть бути видалені із потоку стічних вод механічним шляхом.
Проте якщо ввести позитивних іонів надто багато, то вони можуть
замінити в адсорбційному шарі негативні
іони, що може призвести до зміни заряду
частки на „+”. Це в свою чергу також негативним чином впливатиме на процес
злипання часток. Тому при введені позитивних іонів у воду при коагулюванні,
необхідно дотримуватись оптимальних доз коагулянтів.
Коагулювання води – введення у воду хімічних реагентів з
метою коагуляції домішок.
Коагуляція води – злипання колоїдних часток, що
містяться у воді в більш крупні агрегати.
Коагулянт – хімічна речовина, що вводиться у воду з метою коагуляції.
Типи
коагулянтів
Для очищення води застосовують коагулянти, що гідролізуються,
тобто ті хімічні речовини, які при взаємодії із водою утворюють гідроксиди
металів у вигляді крупних пластівців.
При введені у воду таких речовин утворюються :
Al2(SO4)3+6H2O = 2 Al(OH)3
+ 3H2SO4
. (7.1)
гідроксид алюмінію сірчана кислота
Гідроксид алюмінію має позитивний заряд, в результаті чого
проходить взаємодія між колоїдними частками (коагуляція). Утворюються крупні
агрегати, які швидко випадають в осад. Частинки коагулянту (гідроксиду
алюмінію) також адсорбують на себе розчинені органічні речовини, що сприяє
більш кращому очищенню стічних вод.
В результаті хімічної реакції також утворюється сірчана кислота,
яка уповільнює процес коагуляції. Частина утворюваної кислоти нейтралізується гідрокарбонатними іонами, які є у стічних водах:
H2SO4 + HCO3 = H2O+CO2 . (7.2)
Однак, часто їх не вистачає, тому доводиться нейтралізувати її
шляхом додаткового введення у воду гідрокарбонатних
іонів шляхом застосування вапна.
H2SO4 + Ca(OH)2
= Ca SO4+ H2O . (7.3)
Для очищення води найбільше розповсюдження отримали :
·
Сірчанокислий алюміній
(глинозем);
·
Хлорид заліза;
·
Сульфат заліза;
·
Хлорований залізний
купорос;
·
Змішані алюмо-залізні
коагулянти;
·
Оксихлорид алюмінію або алюмінат натрію.
Фактори,
що впливають на процес коагуляції
1 Аніоновий склад води повинен бути оптимальним. Наявність
значної кількості аніонів, особливо сульфатів (SO42-)
уповільнюють коагуляцію.
2 Температура
води – чим більша температура, тим швидше проходить коагуляція.
3 Перемішування
води – повинне бути оптимальним, так як надто інтенсивне перемішування може
привести до руйнування утворених агрегатів. Цей процес проходить в спеціальних
спорудах – камерах.
Технологія очищення води коагулянтами
Технологія очищення води коагулянтами складається з таких
основних операцій (рис.1):
·
складування реагентів;
·
попереднє прояснення;
·
підлуження води;
·
підготовка й змішування
коагулянту;
·
дозування коагулянту;
·
знебарвлення й прояснення.
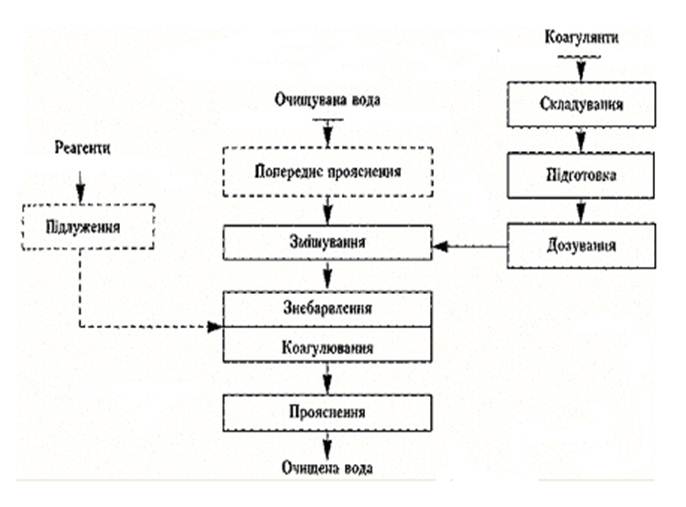
рис.1 Схема технологічного
процесу очищення води коагулянтами
У разі полідисперсного складу завислих речовин, особливо за
наявності поряд з колоїдно-дисперсними грубодисперсних зависей (пісок, часточки руди і нерудних
копалин), стічні води попередньо прояснюють у горизонтальних і аерованих пісковловлювачах з
коловим або прямолінійним рухом води. Дрібніші мінеральні або органічні зависі
відокремлюють також відстоюванням або фільтруванням на повільних фільтрах,
заповнених шаром піску і гравію, або мікрофільтрах.
Попереднє фільтрування на мікрофільтрах можна
здійснювати перед повільними пісковими фільтрами, перед обробкою води
коагулянтами або перед швидкими пісковими фільтрами. Як відстійні споруди
застосовують ставки-відстійники, горизонтальні відстійники та їх поєднання, а
також різноманітні відстійники періодичної і безперервної дії (вертикальні,
горизонтальні, радіальні, трубчасті, пластинчасті тощо). Для відокремлення грубодисперсних речовин застосовують також гідроциклони напірного і безнапірного типів.
Одним з найважливіших технологічних параметрів процесу
очищення води коагуляцією є доза коагулянту, її оптимальна величина залежить
від властивостей дисперсної системи: температури, кількості завислих і колоїдно-дисперсних речовин, кольоровості, іонного складу
дисперсійного середовища, значення рН та інших
фізико-хімічних показників (рис.2). У разі недостатньої дози коагулянту потрібний
ефект очищення не досягається, а в разі надлишку - поряд з перевитратою високо
вартісного реагенту в деяких випадках може погіршитися коагуляція. За 4,5 > рН > 8,5 спостерігається підвищений вміст залишкового
алюмінію в очищуваній воді внаслідок утворення
розчинних основних сульфатів алюмінію за рН< <
4,5 або алюмінату натрію за рН > >8,5.
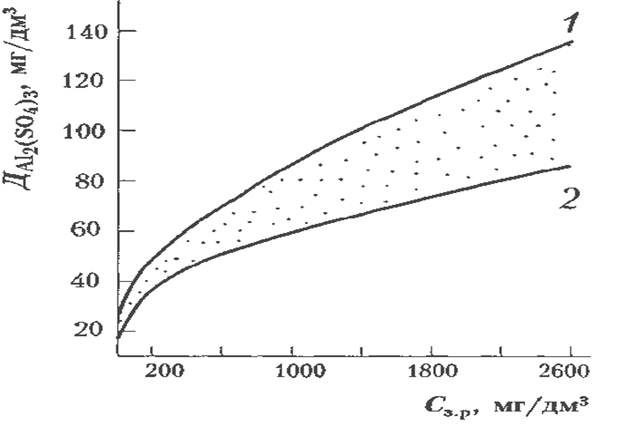
Рис.2 Залежність дози коагулянту від вмісту в очищуваній воді завислих речовин:
1 — тонкодисперсні зависі; 2 — грубодисперсні
зависі
Зі зменшенням температури оброблюваної води доза коагулянту
значно зростає, особливо у разі каламутних вод. Із зменшенням каламутності води
вплив температури менший. Доза коагулянту зростає зі збільшенням вмісту у воді
завислих речовин, особливо для тонкодисперсних
зависей. При значному вмісті завислих речовин вони, вкриваючись
"кожухом" колоїдних часточок гідроксиду алюмінію, коагулюють, запобігаючи
утворенню довгих ланцюгових містків з кулястих часточок.
У результаті цього потрібна менша доза коагулянту. Для високозабарвлених вод з підвищенням їх лужності доза
коагулянту збільшується, для каламутних — зменшується.
Дозу коагулянту визначають методом пробного коагулювання. У
деяких випадках дозу коагулянту АІ2(S04)3, FеСІ3 для мутних вод можна орієнтовно визначити за
формулою:
Дк = 27 + 0.045 Сз, (7.4)
де Сз – концентрація
завислих речовин, мг/л
Очищувану воду підлужують, якщо лужний резерв
недостатній для задовільного гідролізу коагулянтів. У ході підлужування
значення рН підтримують в межах 6,5...7,5. Це сприяє
також зменшенню залишкового вмісту алюмінію і заліза в очищуваній
воді та зниженню її корозійних властивостей.
Дозу лугу визначається як :
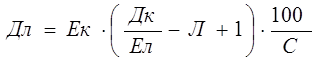 , (7.5)
, (7.5)
де Ек – еквівалентна
маса активної частини коагулянту, мг/мг екв. ;
Ел - еквівалентна маса активної частини лугу, мг/мг екв;
Дк
– доза коагулянту, мг/л;
Л – загальна лужність
води, мг екв/л
;
1 – надлишок лужності;
С – вміст активної речовини в лугові.
Якщо в результаті розрахунків Дл отримується із знаком „ – ” то це означає, що лужності води достатньо і додаткового підлуження не потрібно.
2. Специфіка адсорбції з водних розчинів та межі її застосування
Адсорбція розчинених органічних речовин покладена в основну
багатьох технологічних процесів. Особливо актуальне використання сорбційних процесів у технології глибокого очищення стічних
вод від органічних речовин.
Адсорбція органічних молекул з водних розчинів залежить від
різниці між енергією адсорбційної взаємодії молекул компонентів розчину з
атомами поверхні адсорбенту та енергією взаємодії органічної молекули з
молекулами води, що утворюють за допомогою системи водневих зв'язків
упорядковану структуру рідини. Ця взаємодія визначає розчинність органічної
речовини та енергію, що перешкоджає переходу органічної молекули з водного
оточення на поверхню поділу фаз. У водних розчинах вона значною мірою
визначається структурою рідкої води і змінами структури, що виникають під час
розчинення у воді органічних речовин. Зв'язок молекул розчиненої речовини з
розчинником виявляється насамперед у величинах розчинності та зміні розчинності
речовини з температурою. Тому адсорбція розчинених речовин істотно залежить від
їх розчинності.
Характер взаємодії органічної речовини з водою в розчині
залежить не лише від розмірів і конфігурації молекул, а й від наявності в їх
структурі функціональних груп, здатних утворювати водневі зв'язки.
У разі адсорбції молекул органічних речовин з водних
розчинів на межі поділу фаз тверде тіло — рідина утримуються молекули обох
компонентів розчину. При цьому перехід молекул розчиненої речовини з об'єму
розчину на поверхню адсорбенту визначається різницею взаємодії молекул
розчиненої речовини з адсорбентом і молекулами розчинника. Тому енергія
адсорбції з водних розчинів
завжди менша від енергії адсорбції пари.
Залежно від характеру сорбційної
взаємодії адсорбату та адсорбенту розрізняють фізичну
адсорбцію, активовану адсорбцію і хемосорбцію. Фізична адсорбція зумовлена силами міжмолекулярної взаємодії
Ван-дер-Ваальса, не специфічна, повністю оборотна,
відбувається з великою
швидкістю і має відносно низьку температуру адсорбції.
Активована
адсорбція характерна тим,
що взаємодія адсорбату та адсорбенту відбувається з
утворенням поверхневої сполуки особливого виду, а молекули адсорбенту, які
взаємодіють з молекулами адсорбату (адсорбтиву), залишаються в кристалічних ґратках адсорбенту.
Активована адсорбція специфічна, необоротна, відбувається повільно, з
підвищенням температури швидкість адсорбції помітно зростає, і для неї
характерна велика теплота адсорбції — до декількох сотень кілоджоулів на 1 моль
адсорбату.
Хемосорбція — звичайна хімічна реакція, що відбувається
на поверхні адсорбенту і супроводжується вивільненням теплоти, еквівалентної
теплоті хімічної реакції.
Найчастіше для глибокого очищення стічних вод від
органічних речовин застосовують процес фізичної адсорбції на вуглецевих
сорбентах. Це зумовлено тим, що енергія вандерваальсової
взаємодії молекул органічних речовин з атомами Карбону, які утворюють поверхню
вуглецевих тіл, набагато більша, ніж енергія взаємодії цих атомів з молекулами
води. Адитивність енергії дисперсійної взаємодії органічних речовин з
вуглецевими сорбентами часто дає змогу попередньо обчислити адсорбційні
рівноваги органічних речовин. Схематично баланс енергетичних взаємодій, які
призводять до вибіркової адсорбції органічної речовини з водного розчину, можна
подати рівнянням:
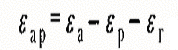 , (7.6)
, (7.6)
де єар —
енергія адсорбції молекул органічної речовини з розчину; єл — енергія адсорбційної взаємодії
молекул цієї речовини за відсутності молекул води та інших компонентів розчину;
єр — енергія взаємодії молекул води
(розчинника) з адсорбентом; єг — енергія
взаємодії молекул розчиненої речовини (газу) з молекулами води в розчині.
У разі адсорбції молекул газів чи пари ступінь заповнення
ними поверхні адсорбенту залежить від величини рівноважного тиску, тобто від
концентрації молекул у газовій фазі. Якщо ж адсорбція відбувається з розчинів,
поверхня адсорбенту, зануреного в рідину, завжди повністю вкрита молекулами
компонентів розчину, тобто відносний ступінь заповнення поверхні поділу фаз
сумою молекул усіх видів (0) завжди
дорівнює одиниці і не залежить від концентрації розчину. В адсорбційному шарі
відбувається лише перерозподіл молекул компонентів розчину відповідно до
енергії їх взаємодії з адсорбентом. Тому для кожного з компонентів розчину
відносна величина заповнення поверхні поділу фаз (0,), іншими словами,
відношення величини поверхні, зайнятої молекулами однієї речовини, до загальної
величини поверхні поділу є функцією рівноважної концентрації молекул органічної
речовини в адсорбційному шарі і в рівноважному розчині характеризує
вибірковість адсорбції цієї речовини з водного розчину. У разі відсутності
вибірковості це співвідношення дорівнює одиниці, тобто концентрація розчину не
змінюється.
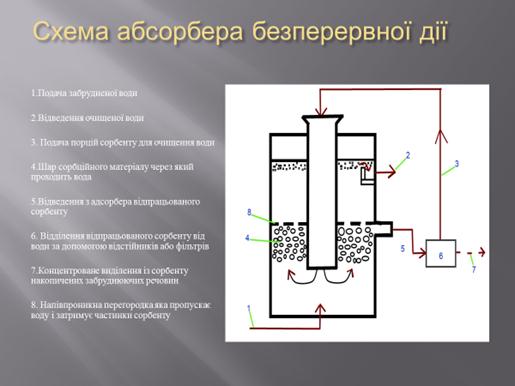
Для очищення води в умовах очисних споруд застосовують
адсорбери різного типу. На рисунку наведений
адсорбер безперервної дії. Стічна вода подається в адсорбер знизу вгору, при цьому вона
рівномірно заповнює перетин колони і контактує з адсорбентом. Очищення стоків у
нерухомому шарі застосовують тоді, коли у стічних водах майже відсутні завислі
частинки. Такі частинки закупорюють проміжки між частинками адсорбенту, у
результаті чого зростає опір шару адсорбенту потоку рідини і знижується
швидкість фільтрування. З часом при такому контакті, адсорбент втрачає свої
властивості через закупорку пор. Тому через трубопровід 5 відпрацьований
сорбент видаляється із адсорбера для його очищення (десорбції або
регенерування). Після цього регенерований сорбент знову направляється для
очищення води.
Вуглецеві
сорбенти
Як уже зазначалось, найбільшого поширення для вилучення
органічних речовин з води набули вуглецеві матеріали завдяки значній енергії
ван-дерваальсової взаємодії адсорбат—адсорбент.
Під час дослідження адсорбції на вуглецевих сорбентах і практичного
використання адсорбції органічних речовин має значення оцінка внеску
поверхневих оксидів вуглецевих сорбентів у загальну величину енергії і
врахування пористої структури вуглецевих сорбентів.
Часто як домішку до активованого вугілля використовують
кисень. Його вміст коливається від 2 до 25 % (в окисненому активованому вугіллі).
Щонайменше 25 % усього кисню, що міститься в активованому окисненому вугіллі,
входить до складу поверхневих оксидів, які мають властивості об'ємних сполук з відповідними функціональними групами. Більш
поширені і вивчені кислотні поверхневі групи, що містять кисень. Такі
поверхневі групи вугілля і сажі не беруть участі у взаємодії молекул
ароматичних похідних з поверхнею вуглецевих адсорбентів і не впливають на
фізичну адсорбцію неполярних органічних речовин з парової фази. Специфічна
взаємодія поверхні вугілля з органічними речовинами спостерігалась лише за
наявності карбонільних груп на поверхні вугілля та виникненні донорно-акцепторних комплексів.
За характером пористості всі адсорбенти А.В.Кисельов
поділив на чотири типи:
1 непористі;
2 однорідно-великопористі;
3 однорідно-дрібнопористі;
4 неоднорідно-пористі.
Всі пори вуглецевих сорбентів можна розподілити на три
групи за величиною їх ефективного радіуса (ефективний радіус дорівнює
подвійному відношенню площі нормального перерізу пори до її периметра). Макропори відповідно до цієї класифікації,
мають ефективний радіус, який перевищує 100,0 нм. Пори, що мають ефективні
радіуси від 100,0 до 15—16 нм, є перехідними.
Пори з ефективним радіусом менш як 1,5 нм являють собою мікропори. Де-Бур із співавторами
відокремили із загальної кількості пор з радіусом менш як 1,5—1,6 нм групу субмікропор радіусом < 0,7 нм. У площині
перерізу таких пор може розміститися не більше двох молекул (азоту або аргону).
Пори радіусом менш як 1,5 нм, але більш як 0,5— 0,7 нм дістали назву супермікропор. Супермікропори
являють собою перехідну ділянку пористості, протягом якої характерні ознаки
мікропор поступово зникають, а властивості мезопор
виявляються. Загальна питома поверхня макропор не
перевищує (2—4)-103 мг/кг, питома поверхня перехідних пор
з радіусом > 1,5 нм не перевищує 400 • 103 м2/кг. У
ділянці пор з радіусом понад 0,5 нм і менш як 1,5—1,6 нм і відбувається
переважно як адсорбція пари, так і адсорбція з розчинів.
Структура адсорбенту значною мірою визначає його питому
витрату під час адсорбції розчинених речовин і таким чином впливає на
економічність адсорбційної технології. Очевидно, що мікропори, розміри яких
менші від молекул розчинених речовин, не беруть участі в процесі адсорбції і тому
в процесі адсорбції складних
молекул органічних речовин (наприклад, поверхнево-активних речовин, барвників
або полімерів) є некорисною частиною пористої структури, тоді як у разі
адсорбції відносно невеликих молекул об’єм мікропор становить головну частину
адсорбційного об’єму пор адсорбенту. Об'єм дуже широких пор також не
використовується повністю для вибіркової адсорбції з водних розчинів, оскільки
вибіркова адсорбція здійснюється лише в мономолекулярному шарі розчину на їх
поверхні, а питома поверхня пор швидко зменшується зі збільшенням їх діаметра.
Оцінка розмірів молекул речовин у промислових стічних водах, направлених на
адсорбційне очищення, дає змогу визначити раціональні межі розмірів пор
адсорбентів, призначених для цих цілей. Міцели ПАР, барвників та гумінових
речовин, що утворюються у водних розчинах внаслідок асоціації окремих
неіонізованих або іонізованих молекул за наявності сильних електролітів, мають
лінійні розміри, які здебільшого не перевищують 10 нм.
Отже, для вилучення органічних речовин з водних розчинів
потрібні адсорбенти з порами, ефективний радіус яких укладається в інтервал
0,5 — 10 нм. Тобто не лише макропористість, а й
наявність перехідних пор (мезопор), ефективний
радіус яких перевищує 10 нм, є істотним недоліком пористої структури
адсорбенту. Мікропори з радіусом менш як 0,5 нм також, як правило, непридатні
для адсорбції органічних речовин з розчинів, оскільки вони недоступні практично
для всіх органічних молекул.
Синтетичні
полімерні сорбенти
Останнім часом поряд з активованим вугіллям все ширшого
вжитку набувають синтетичні полімерні адсорбенти, які вперше були синтезовані
наприкінці 50-х років, їх пориста структура може змінюватися за однієї й тієї
самої хімічної будови в дуже широких межах, що досягається шляхом варіювання
вмісту вихідних компонентів під час синтезу пористих полімерів.
При цьому можна отримувати адсорбенти, які мають переважно
гідрофобні або гідрофільні властивості. Найбільш гідрофобними є співполімери
стиролу і дивінілбензолу; співполімери
метилметакрилату і стиролу, вінілпіридину і
фенол-формальдегіду, вінілпіридину та дивінілбензолу більш гідрофільні і тому, очевидно,
особливо придатні для адсорбції з розчинів гідрофільних сполук.
В Україні та Росії в останні роки почалось промислове
виробництво пористих полімерних адсорбентів на основі стиролу і дивінілбензолу, які можна використовувати для поглинання
деяких органічних речовин (наприклад, нітропохідних,
хлорпохідних аліфатичних та ароматичних вуглеводнів) з промислових стічних вод.
Ці сорбенти відомі під назвою "полісорби".
Запитання
для контролю
1.
Застосування коагуляції для очищення води.
2.
Будова та взаємодія колоїдних часток.
3.
Типи коагулянтів та хімічні реакції взаємодії із водою.
4.
Дози коагулянтів та лугу при коагуляції води.
5.
Адсорбція розчинених
шкідливих речовин стічної води.
6.
Види адсорбції.
7.
Типи сорбентів для очищення води.
8.
Методи регенерування
адсорбентів.
9.
Технологічні схеми установки
з використанням адсорбційних методів.